Document
Exhibit 99.1
センテッサ・ファーマシューティカルズ、2025年第3四半期決算を発表
オレキシン受容体2(OX2R)アゴニスト・プログラムに関する最新情報を発表
-ORX750:ナルコレプシー1型(NT1)、ナルコレプシー2型(NT2)、特発性過眠症(IH)の治療薬として、現在進行中のフェーズ2a試験の初期コホートにおいて、クラス最高のプロファイルの可能性を実証。
-ORX142:フェーズ1データが高度に差別化されたプロファイルを支持、2026年第1四半期に患者試験を開始予定
-ORX489:IND取得可能な試験が進行中、2026年第1四半期に臨床試験を開始予定
ボストンおよびロンドン、2025年11月5日--臨床段階の製薬会社であるセンテッサ・ファーマシューティカルズ plc(Nasdaq:CNTA)は本日、2025年9月30日に終了した第3四半期の決算を発表し、現在進行中のORX750のNT1、NT2およびIH参加者を対象としたCRYSTAL-1試験における初回投与コホートのフェーズ2aデータ1や、健康なボランティアを対象としたORX142の進行中試験のフェーズ1データ2など、OX2Rアゴニスト・プログラムに関する最新情報を提供しました。
「センテッサ社の最高経営責任者(CEO)であるサウラブ・サハ医学博士は、「私たちは、成長過程にあるOX2R作動薬プログラムの臨床データによって示された大きな進展を共有できることを嬉しく思います。「ORX750は、NT1、NT2およびIHの治療薬として、またNT2およびIHを治療する最初のOX2Rアゴニストとして、クラス最高のOX2Rアゴニストになる可能性があります。ORX750は、3つの適応症すべてに低用量で投与されたフェーズ2aの初期コホートにおいて、覚醒維持テスト(MWT)、エプワース眠気尺度(ESS)、週間カタプレキシー率(WCR)などの主要な指標において、統計学的に有意で、臨床的に意味のある、用量依存的な結果を達成しました。これらのデータを支えているのは、本試験を通じて観察された全般的に良好な安全性と忍容性のプロファイルである1。これらのデータは、ORX750の治療域が潜在的に広いことを示すものであり、現在進行中の用量漸増コホートにおいて、有効性と投与量の柔軟性をさらに高める可能性を裏付ける強力なメカニズム的根拠を提供するものである。これらのコホートにおける登録の勢いを考えると、ORX750の登録プログラムは2026年第1四半期に開始される見込みです。"
ORX142は、高い効力と選択性、迅速な作用発現、差別化された薬物動態(PK)、全般的に良好な安全性と忍容性プロファイルを特徴とする高度に差別化されたプロファイルを、健常人ボランティアを対象としたフェーズ1データ2により実証しました。このデータの強さを踏まえ、当社は臨床開発を進めており、非公開の適応症について2026年第1四半期に患者試験を開始する予定です。これと並行して、これまでで最も強力なOX2Rアゴニスト候補薬であるORX489は、INDの取得を可能にする試験を進めており、INDのクリアランスを条件として、2026年第1四半期に臨床試験を開始する予定です。複数の差別化されたオレキシン作動薬が進展していることから、当社はこの新興クラスにおける明確なリーダーシップを確立し、神経科学における持続的かつ長期的な成長基盤を構築しつつあると確信しています。"
ORX750第2a相試験の最新情報
初期投与コホートによるフェーズ2aデータ1は、内因性オレキシンを欠くNT1患者と、オレキシンレベルが正常から変動するNT2患者およびIH患者という幅広い集団において、経口OX2Rアゴニストが覚醒の必要性に対応することを初めて実証したものである。
第 2a 相試験の更新データには、2025 年 9 月 23 日のデータカットオフ日現在、2 週間のクロスオーバーコホートで ORX750 の投与を完了した NT1、NT2 および IH の参加者合計 55 名が含まれています。ORX750 は、各適応症で試験された全用量で一般的に良好な忍容性が認められ、治療上発現した有害事象(TEAE)はすべて一過性で、重篤度は軽度から中等度であった。NT2群では尿意切迫感により1名が投与を中止した。心機能、視機能、肝機能、腎機能に臨床的に意味のある変化は認められなかった。NT1、NT2、IHの全コホートで最も一般的な有害事象(10%以上)は、頻尿(51%)、不眠(22%)、めまい(13%)、頭痛(11%)であった。
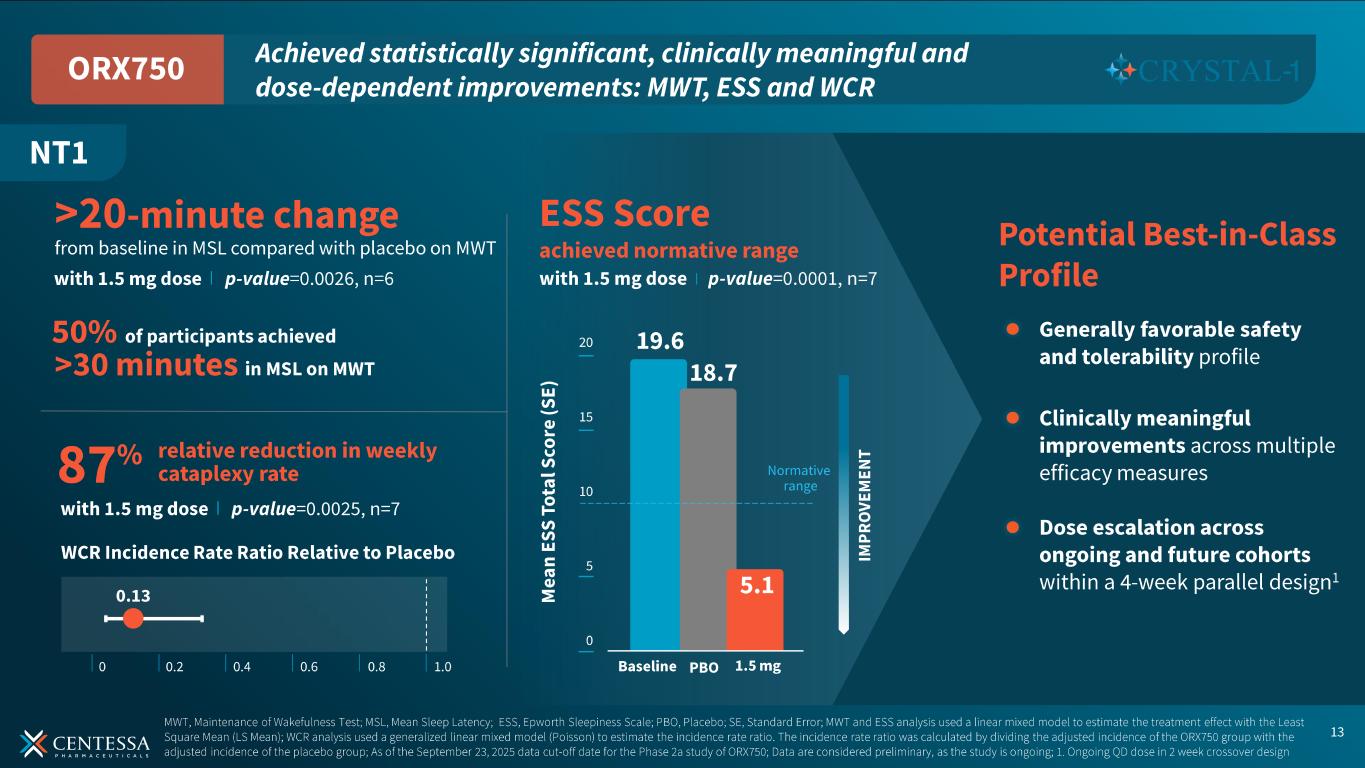
NT1 の初回用量コホートには、1.0 mg と 1.5 mg を 1 日 1 回投与し、無作為化 2 週間クロスオーバーを行った。NT1については、ORX750は達成した:
-ORX750の1.5mg群(n=6)では、2週目のMWTでプラセボと比較して平均睡眠潜時がベースラインから20分以上改善した(p値=0.6)。1.5mgコホート(n=6)では、2週目のMWTにおいて、ORX750はプラセボと比較して平均睡眠潜時でベースラインから20分以上の変化を示し(p値=0.0026)、半数の参加者がMWTにおいて平均睡眠潜時で30分以上の変化を示した。用量漸増は、1日1回投与と分割投与の両方のレジメンで進行中である。
-両投与量において、ESS 総スコアはプラセボと比較してベースラインから統計学的に有意かつ臨床的に意義のある用量依存的な改善を示した。1.5mg群(n=7)では、第2週時点のESS合計スコアがプラセボ群(18.7点)に対してORX750群(5.1点)で有意に改善した(p値=0.0001)。ベースライン時の平均ESSスコアは19.6点であった。
-両用量において、統計学的に有意かつ臨床的に意義のある用量依存的な週間カタプレキシー発生率(WCR) の低下が認められた。1.5 mg 群(n=7)では、ORX750 投与群では、プラセボ群と比較して WCR が 87%減少し、2 週目における推定発症率比は 0.13(p値=0.0025)であった。
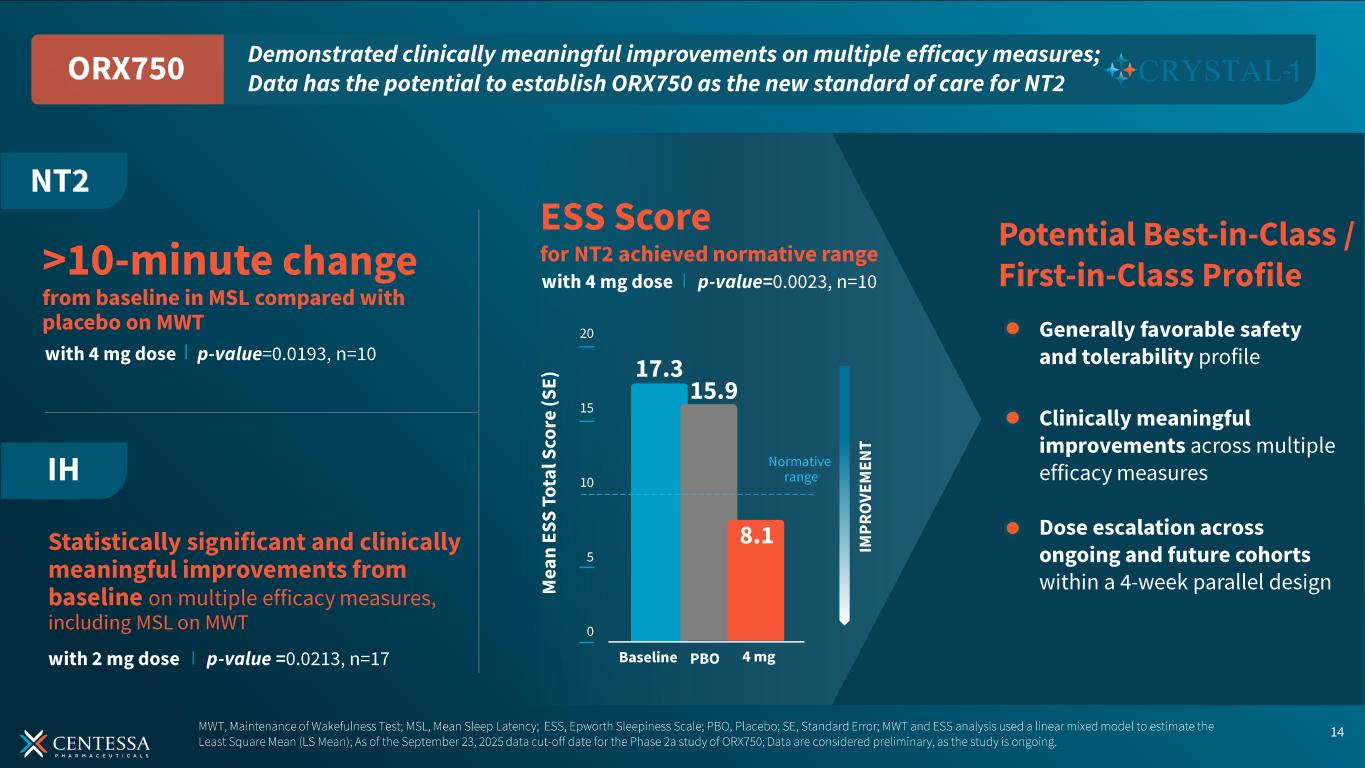
NT2 の初回用量コホートには、2.0 mg と 4.0 mg を 1 日 1 回投与し、2 週間の無作為クロスオーバーを行った。NT2については、ORX750が達成した:
-両投与量において、MWT の平均睡眠潜時がプラセボと比較してベースラインから統計学的に有意かつ臨床的に意味のある用量依存的な改善を示した。4.0mg群(n=10)では、2週目のMWTにおいて、ORX750はプラセボと比較して平均睡眠潜時がベースラインから10分以上変化した(p値=0.0193)。用量漸増は、1日1回投与と分割投与の両方のレジメンで進行中である。
-両投与量において、ESS 総スコアはプラセボと比較してベースラインから統計学的に有意かつ臨床的に意味のある用量依存的な改善を示した。4.0mg群(n=10)では、第2週時点のESS合計スコアの平均がプラセボ群15.9点に対し、ORX750群8.1点であった(p値=0.0023)。ベースライン時の平均ESSスコアは17.3点であった。
最初のIH用量コホートでは、無作為化2週間クロスオーバー試験において、2.0mgを1日1回投与した。この用量(n=17)において、ORX750は、MWTの平均睡眠潜時を含む複数の有効性指標において、プラセボと比較してベースラインから統計学的に有意かつ臨床的に意味のある改善を達成した(p値=0.0213)。用量漸増は進行中である。
「これらの初期コホートにおいて、ORX750はすでにMWT、ESS、WCR(NT1における症状の正常化を示す重要な指標)の顕著な改善を達成しており、臨床的有効性は、覚醒度や日常生活機能における実社会での有意義な改善につながりました。さらに、ORX750の特徴的なPKプロファイルは、一日中作用時間が長く、安全性と忍容性が概ね良好であることに寄与しています」とCentessa Orexin Program社長のMario Alberto-Accardi博士は述べています。「ORX750はまた、NT2において臨床的に意義のある航跡促進を達成し、現在までに観察された改善により、ORX750をNT2の新たな標準治療薬として確立できる可能性があります。また、IH においては、ORX750 は、MWT を含む複数の有効性指標において、統計学的に有意かつ臨床的に意義のある改善を示した初めての OX2R 作動薬です。現在進行中のコホートには50人以上の参加者がおり、すべての適応症において有効性と投与方法の柔軟性がさらに高まることを期待しています。本試験の成功における患者、治験責任医師、臨床試験実施医療機関の継続的なパートナーシップと支援に深く感謝しています。
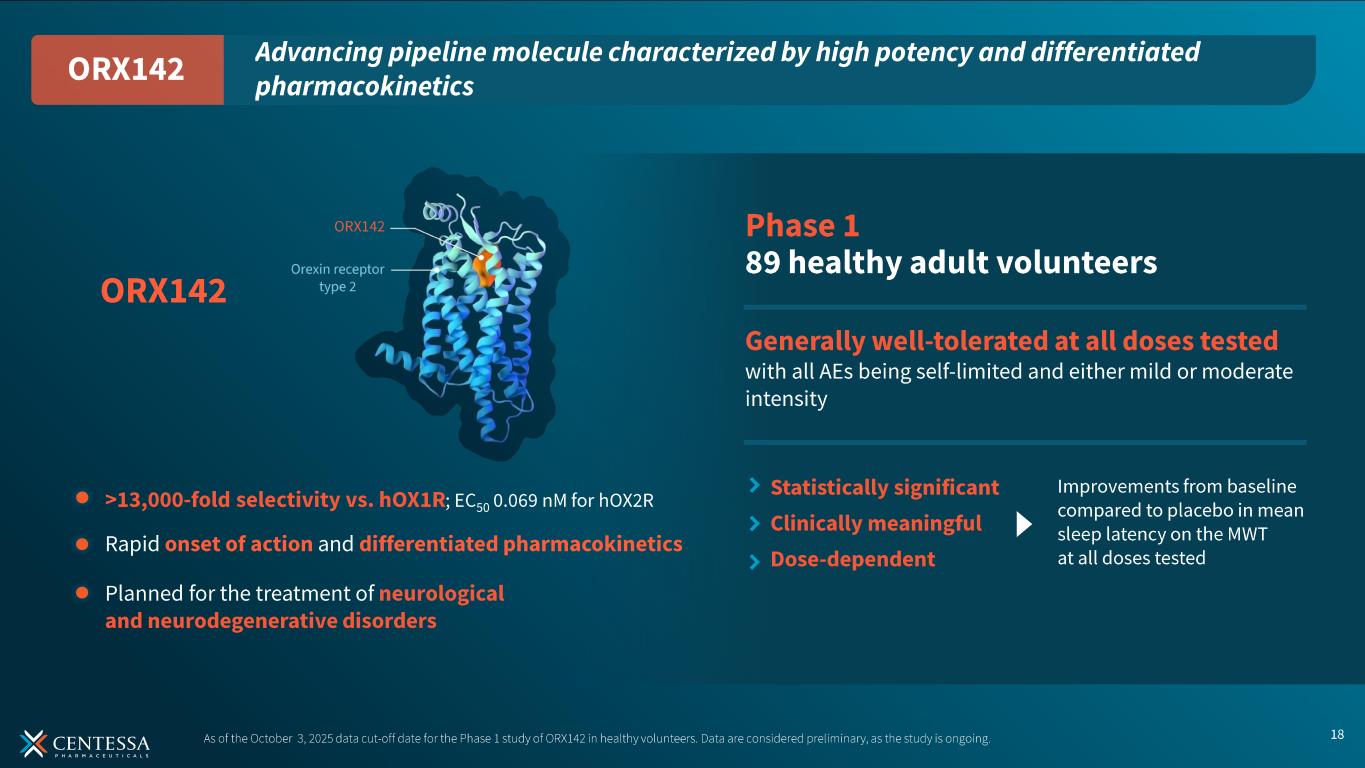
ORX142第1相試験の最新情報
第 1 相試験の更新データには、2025 年 10 月 3 日のデータカットオフ時点で ORX142 を投与された合計 89 名の健常成人ボランティアが含まれている。ORX142は、速やかな作用発現、差別化された薬物動態を示し、試験されたすべての用量で概して良好な忍容性が観察された。さらに、ORX142は、急性睡眠不足の健常人ボランティアにおいて、試験したすべての用量で、MWTの平均睡眠潜時について、プラセボと比較してベースラインから統計学的に有意かつ用量依存的に改善した。ORX142の第1相試験データを総合すると、未公開の適応症を対象とした患者試験が計画されている。
ox2rアゴニストのパイプラインと予想される今後のマイルストーン
-ORX750:フェーズ2aのCRYSTAL-1試験が進行中。2026年第1四半期に登録プログラム開始予定。
-ORX142:第1相ファースト・イン・ヒト試験が進行中。2026年第1四半期に患者試験を開始予定。
-ORX489:IND取得に向けた試験を推進中。当社は、2026年第1四半期にINDを取得し、臨床試験を開始することに注力している。
2025年第3四半期決算
-現金、現金同等物および投資:現金、現金同等物および投資:2025年9月30日現在の現金、現金同等物および投資の合計は3億4,900万ドルである。当社は、2025年9月30日現在の現金、現金同等物および投資で、2027年半ばまでの事業運営を賄えると見込んでいる。
-研究開発費:研究開発費は、2024年9月30日に終了した第3四半期の3,390万ドルに対し、2025年9月30日に終了した第3四半期は4,160万ドルでした。
-一般管理費:一般管理費:2025 年 9 月 30 日に終了した第 3 四半期の一般管理費は、前年同期の 1,250 万ドルに対し、1,220 万ドルでした。
-純損失:2025年9月30日に終了した第3四半期の純損失は5,490万ドル(2024年9月30日に終了した第3四半期は4,260万ドル)。
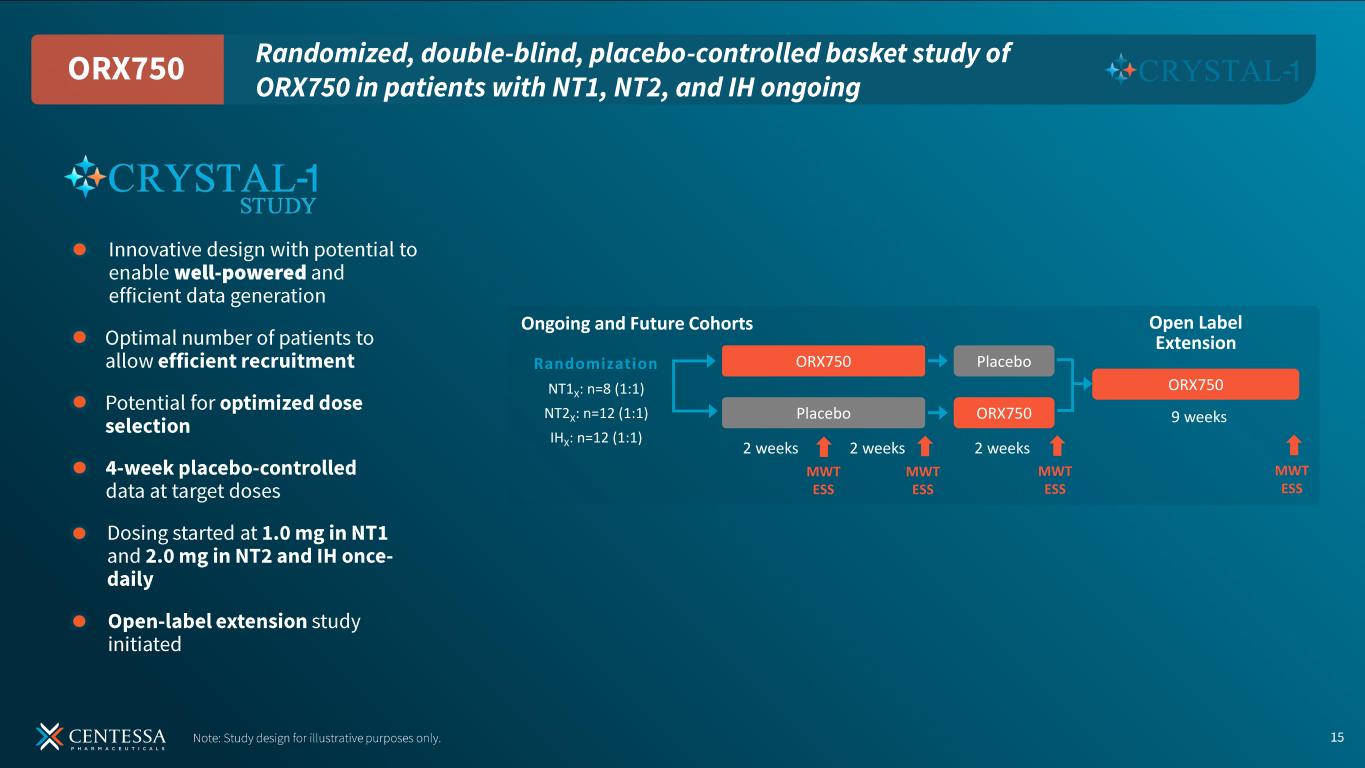
About the CRYSTAL-1 Study
現在進行中の CRYSTAL-1 試験は、過眠中枢障害を対象とした ORX750 の第 2a 相適応無作為化二重盲検プラセボ対照試験です。本試験の目的は、ORX750の安全性と忍容性を実証し、薬物動態(PK)および薬力学(PD)を評価し、各適応症におけるORX750の最適用量を同定し、登録プログラムに反映させることである。初回投与コホートでは、NT1、NT2、およびIHの患者からなる独立したコホートを募集し、ORX750とプラセボをクロスオーバー方式で無作為に投与した(すべての参加者は、比較のために2週間のORX750と2週間のプラセボの両方を受け、すべての患者が自身の対照となった)。安全性と忍容性は、標準的な有害事象(AE)収集、臨床検査、心電図、バイタルサインを用いて評価した。有効性は、MWTの平均睡眠潜時とESSの日中の過度の眠気のベースラインからの変化で評価され、それぞれプラセボと比較され、NT1参加者については、プラセボと比較したWCRの発生率比で評価された。各適応コホート終了後、観察された安全性、忍容性、曝露および有効性に基づき、新たな用量が選択され、安全性審査委員会により審査された。
最初の投与コホートの後、試験は4週間の並行デザインに変更され、1コホートあたりNT1の参加者が少なくとも8人、NT2またはIHの参加者が少なくとも12人登録された。このデザインでは、現在進行中および将来のコホートの参加者は、盲検化された2つの治療順序のいずれかに無作為に割り付けられ、ORX750またはプラセボのいずれかを4週間投与された後、もう一方の治療に2週間クロスオーバーする。有効性は最初の4週間の治療期間後に評価される。CRYSTAL-1の終了後、参加者はORX750の進行中の9週間の非盲検長期延長試験(LTE)に登録することができ、各条件ごとにコホートが分けられる。
臨床試験に関する情報は、ClinicalTrials.gov(NCT06752668およびNCT07096674)にも掲載されている。
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方に
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施
会社開示情報をすべてご覧になるには株探プレミアムの登録
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧にな
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プ
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が
SVP of Investor Relations
investors@centessa.com
会社開示情報をすべてご覧になるには株探プレミアムの登録が必
会社開示情報をすべてご覧になるには株探プレミアムの
(unaudited)
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30
会社開示情報をすべてご覧になるには株探プレミアムの登録が必
(unaudited)
(amounts in thousands)
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株















 株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン
株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン