Document
バリンタス・バイオ社、2024年第1四半期決算および企業動向に関する最新情報を発表
英国オックスフォードフォード2024年5月13日(GLOBE NEWSWIRE) - 慢性感染症、自己免疫、がんを克服するために免疫系を誘導するように設計された新規T細胞免疫治療薬候補を開発する臨床段階のバイオ医薬品企業であるバリントス・バイオセラピューティクス plc(NASDAQ: BRNS)は、2024年第1四半期の決算を発表し、当社の進捗状況の概要を発表した。
「2024年のこれまでのところ、私たちはプログラム全体で前進を続けています。特に、セリアック病を対象とした初のヒト臨床試験において、VTP-1000の治験許可申請をFDAから受理され、オーストラリアの倫理委員会からもこの試験に関する許可を得ました。今後数ヶ月のうちに、セリアック病患者を対象としたVTP-1000の第1相臨床試験を開始する予定です。さらに、持続性高リスク(hr)ヒトパピローマウイルス(HPV)感染者を対象としたVTP-200のフェーズ1b/2試験のトップライン最終データを報告しました。「第2四半期に向けて、6月に開催される欧州肝臓学会(EASL)でVTP-300のB型肝炎試験の中間データを発表する予定です。これは、昨年11月に開催された米国肝臓病学会(AASLD)の肝臓会議(The Liver Meeting®)で発表された有望なデータに続くものです。
また、6月にはレオン・フートマン医師を新しい最高医学責任者として迎え、当社の強力なパイプラインとプログラムの成長を支えてくれることを期待しています。
Recent Corporate Developments
Clinical developments
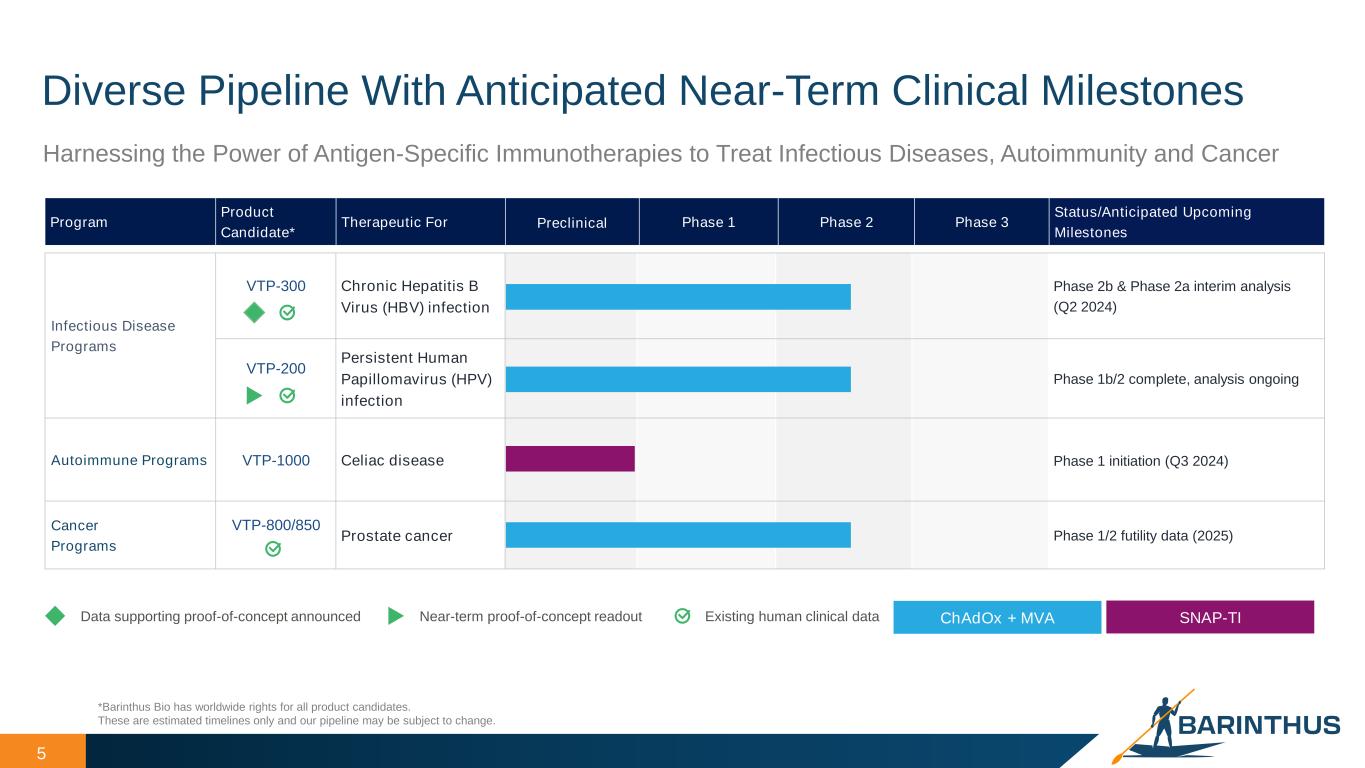
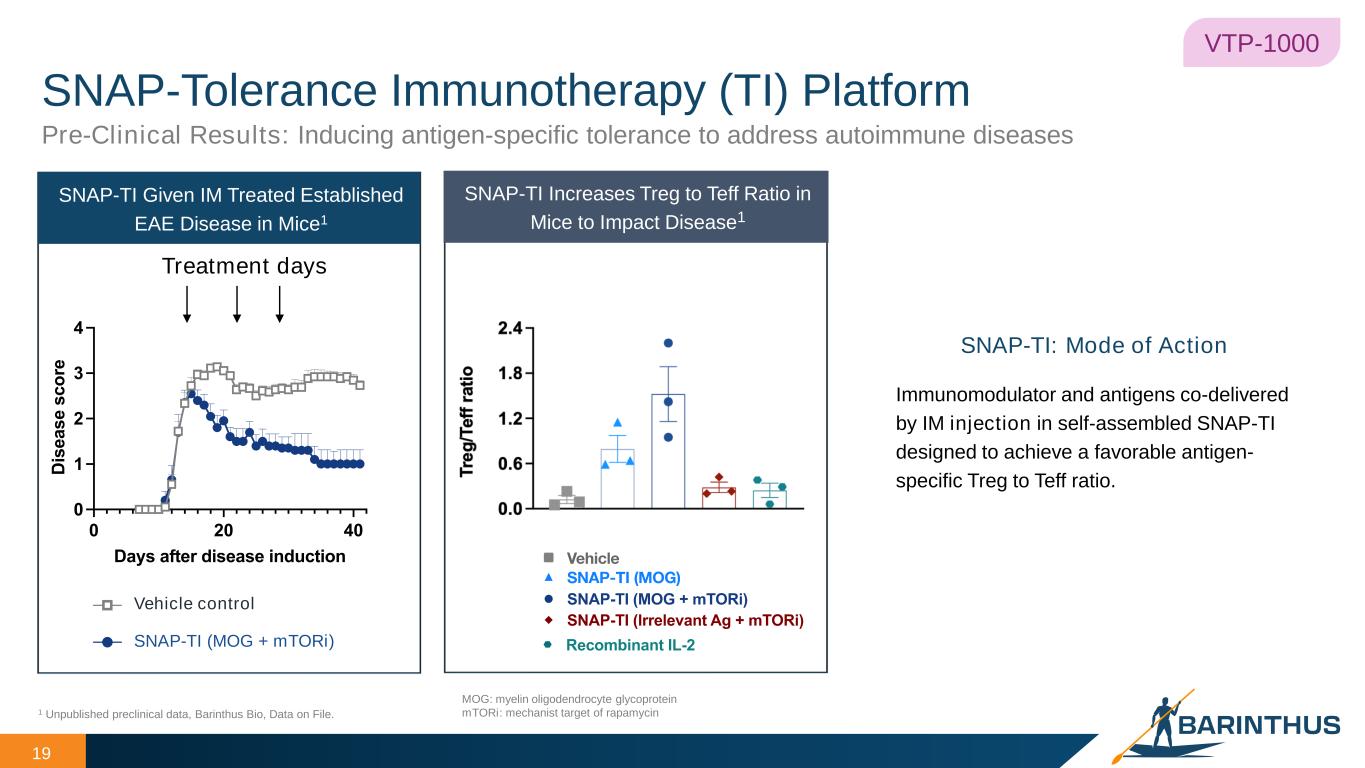
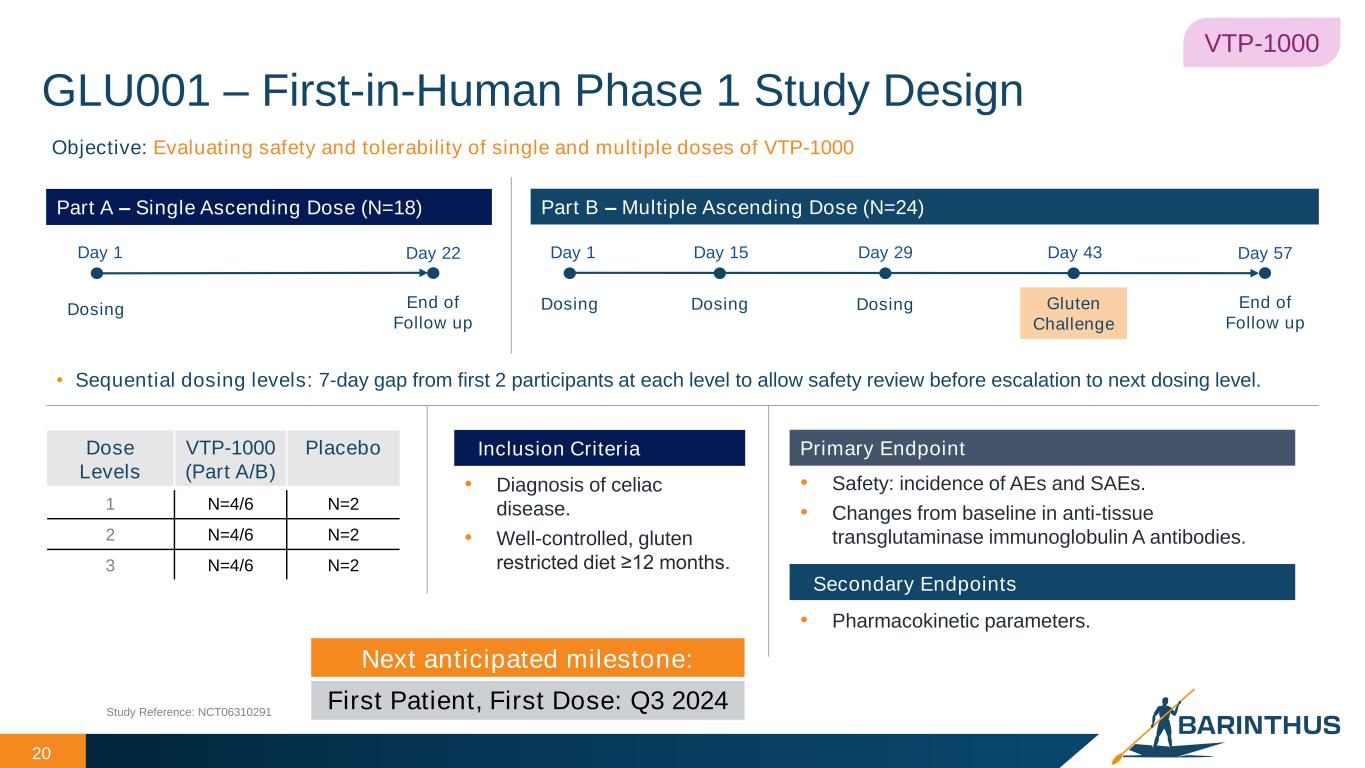
-VTP-1000(セリアック病):VTP-1000(セリアック病):2024年4月、VTP-1000のセリアック病を対象とした初のヒト臨床試験を実施するため、米国FDAより治験許可申請を行い、オーストラリア規制当局からも許可を取得しました。GLU001は、成人のセリアック病患者を対象に、VTP-1000の安全性、忍容性、薬物動態、薬力学を評価するため、グルテンチャレンジを対照とした無作為化プラセボ対照第1相試験です。本試験は2つのパートで構成され、単回上乗せ投与パートと複数回上乗せ投与パートがあり、それぞれ3つの用量レベルで無作為化プラセボ対照試験が行われます。主要評価項目は、単回投与と複数回投与の安全性と忍容性を評価し、さらに検討すべき用量とスケジュールを決定することである。本試験はまた、薬力学的評価とコントロールされたグルテンチャレンジによって決定される予備的有効性に基づき、免疫寛容の誘導の原理的証明と、セリアック病の治療薬としてのVTP-1000の早期概念実証を行うことも目的としている。
-VTP-200(HPV):2024年4月、当社はhrHPVの持続感染に伴う低悪性度子宮頸部病変を有する女性を対象としたVTP-200のフェーズ1b/2用量設定試験であるAPOLLO試験(HPV001としても知られる)のトップライン最終データを発表しました。APOLLO試験では、主要評価項目を達成し、VTP-200の忍容性が概ね良好であることが示され、治療に関連するグレード3以上の任意有害事象(AE)および治療に関連する重篤なAEは認められなかった。hrHPV(60%、第2群)および子宮頸部病変(67%、第2群および第5群)のクリアランス率は、ChAdOxの最高用量投与群で良好な傾向が観察された。5つの異なる有効用量群のプールデータでは、プラセボ群と比較して、hrHPVおよび子宮頸部病変のいずれにおいても統計的に有意なクリアランスの改善は認められなかった。
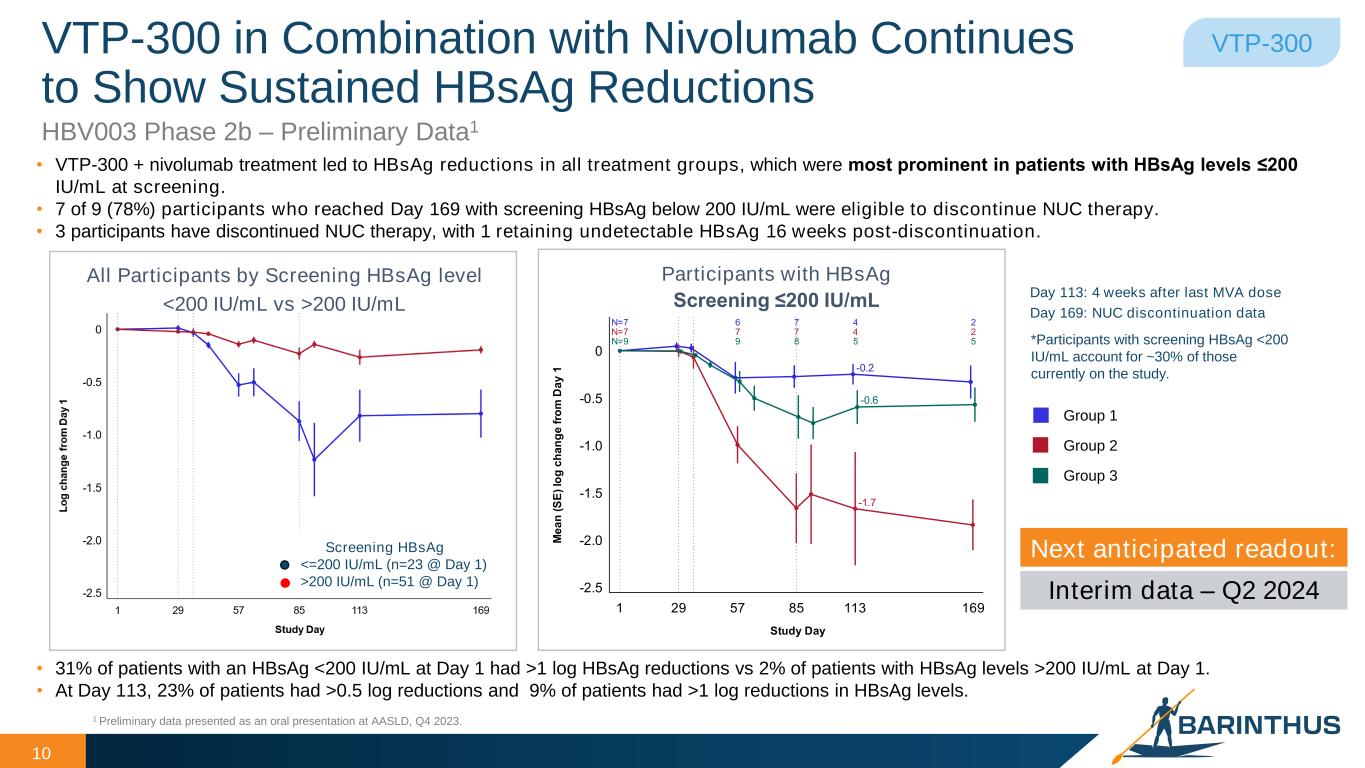
-VTP-300(HBV):2024年4月、HBV003とAB-729-202の中間データに関する抄録が、2024年6月5~8日にイタリア・ミラノで開催されるEASL Congressでの発表用に受理された。
Management Team
-2024年5月1日、当社はレオン・フフトマン博士を最高医学責任者に任命したことを発表しました。フフトマン医師は2024年6月3日に入社し、免疫学、自己免疫学、血液学、腫瘍学、感染症学など幅広い治療分野における医薬品開発の専門知識をもたらします。
Upcoming Milestones
-2024年第2四半期に、当社は以下を期待している:
VTP-300(HBV):ヌクレオス(t)イデアナログ(NUC)治療中のB型慢性肝炎患者を対象としたVTP-300の追加投与とPD-1阻害のタイミングを評価するフェーズ2b試験であるHBV003の中間データを6月のEASL Congressで発表する。
VTP-300(HBV):VTP-300とArbutus社のimdusiranの併用療法をNUC療法中のCHB患者を対象に評価した臨床第2a相試験AB-729-202の中間データを6月のEASL Congressで発表。
-2024年第3四半期に、当社は以下を期待している:
VTP-1000(セリアック病):VTP-1000(セリアック病):成人のセリアック病患者を対象としたVTP-1000の安全性、忍容性、薬物動態、薬力学を評価するため、グルテン負荷試験を伴う無作為化プラセボ対照第Ⅰ相試験であるGLU001の最初の患者を投与する。本タイミングアップデートは、最新の実現可能性と予想される試験実施施設の設定スケジュールに基づいています。
2024年第1四半期 財務ハイライト
-キャッシュポジション:2024年3月31日現在、現金、現金同等物および使途制限付き現金は、2023年12月31日現在の1億4,210万ドルに対し、1億3,000万ドルであった。2024年第1四半期に営業活動に使用した現金は1,180万ドルで、これは主にパイプラインの開発と進行中の臨床試験によるものです。当社は、現在の研究開発計画に基づき、2025年第4四半期までの営業費用および資本支出に必要な資金を手元資金で賄えると見込んでいる。
-収益:2024 年第 1 四半期の収益は、2023 年第 1 四半期の 0.5 百万ドルに対してゼロであり、これは 2024 年にアストラゼネカによる Vaxzevria® の商業販売がなかったためである。
-研究開発費:研究開発費は、2023年度第1四半期の980万ドルに対し、2024年度第1四半期は1,110万ドルであり、その主な増加要因は、人員の採用および当社プログラムの推進に関連する費用の増加である。プログラムごとの研究開発費の前四半期比の概要は以下の通り。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Year ended |
|
2024年3月31日に終了した3ヵ月間 |
|
2023年3月31日に終了した3ヵ月間 |
|
Change |
|
|
$000 |
|
$000 |
|
$000 |
| プログラム別の直接的な研究開発費: |
|
|
|
|
|
|
| VTP-200 HPV |
|
$ |
1,253 |
|
|
$ |
1,338 |
|
|
$ |
(85) |
|
| VTP-300 HBV |
|
1,913 |
|
|
2,118 |
|
|
(205) |
|
| VTP-500 MERS1 |
|
172 |
|
|
— |
|
|
172 |
|
| VTP-600 NSCLC2 |
|
164 |
|
|
275 |
|
|
(111) |
|
| VTP-850 Prostate cancer |
|
178 |
|
|
215 |
|
|
(37) |
|
| VTP-1000 Celiac |
|
1,374 |
|
|
1,572 |
|
|
(198) |
|
| その他のプログラム3 |
|
784 |
|
|
280 |
|
|
504 |
|
| 直接研究開発費合計 |
|
$ |
5,838 |
|
|
$ |
5,798 |
|
|
$ |
40 |
|
| 間接的な研究開発費: |
|
|
|
|
|
|
| Personnel-related (including share-based compensation) |
|
4,335 |
|
|
3,601 |
|
|
734 |
|
| Facility related |
|
390 |
|
|
371 |
|
|
19 |
|
| Other indirect costs |
|
562 |
|
|
44 |
|
|
518 |
|
| 間接研究開発費合計 |
|
5,287 |
|
|
4,016 |
|
|
1,271 |
|
| 研究開発費合計 |
|
$ |
11,125 |
|
|
$ |
9,814 |
|
|
$ |
1,311 |
|
1VTP-500の開発は、CEPI(Coalition for Epidemic Preparedness Innovations)との合意に基づき資金提供されている。
2VTP-600 NSCLCフェーズ1/2a試験はCancer Research UKがスポンサーとなっている。
3VTP-1100 HPV Cancerに関連する研究開発費は、以前はVTP-1000 Celiacに含まれていましたが、リソースを他の臨床プログラムに集中し、HPV CancerにおけるVTP-1100のIND申請を延期しているため、現在は「その他および初期段階のプログラム」に含まれています。
-一般管理費:一般管理費は、2023 年第 1 四半期の 1,210 万ドルに対し、2024 年第 1 四半期は 600 万ドルであった。610万ドルの減少は主に、2023年第1四半期が350万ドルの損失であったのに対し、2024年第1四半期は120万ドルの為替差益を計上したこと、主に現金支出を伴わない株式報酬費用の減少により、株式報酬費用を含む人件費が0.8百万ドル減少したこと、保険料の減少により保険費用が0.9百万ドル減少したことに関連しています。
-純損失:2024年第1四半期の当社株主に帰属する純損失は1,550万ドル(基本ベースおよび完全希薄化ベースともに1株当たり(0.40ドル))であったのに対し、2023年第1四半期の当社株主に帰属する純損失は1,820万ドル(基本ベースおよび完全希薄化ベースともに1株当たり(0.48ドル))であった。
About Barinthus Bio
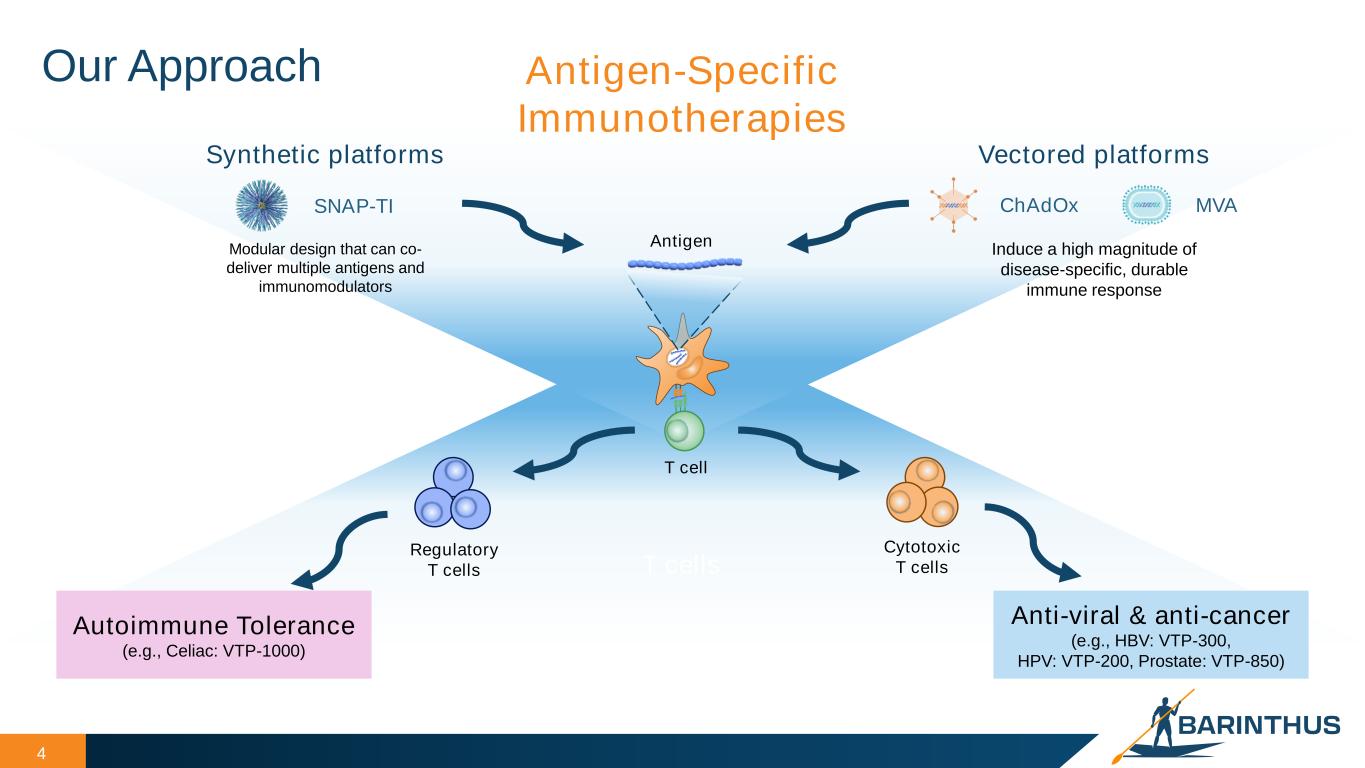
バリンタス・バイオ社は、慢性感染症、自己免疫、癌を克服するために免疫系を誘導するようデザインされた新規T細胞免疫療法候補化合物を開発する臨床段階のバイオ医薬品企業である。重篤な疾患と闘う人々やその家族を支援することが、バリントス・バイオ社の基本理念である。3つの独自プラットフォーム技術を中心に幅広いパイプラインを構築している:ChAdOx、MVA、SNAPの3つの独自プラットフォーム技術を核とした広範なパイプラインにより、バリンタス・バイオ社は、以下を含む多様な治療領域にわたる5つの製品候補のパイプラインを進めている:VTP-300は慢性HBV感染症の機能的治療薬としてデザインされた免疫療法候補薬、VTP-200は持続性高リスクヒトパピローマウイルス(HPV)に対する非手術的製品候補薬、VTP-1000はSNAP-Tolerance Immunotherapy(TI)プラットフォームを利用してセリアック病患者の治療にデザインされた自己免疫疾患候補薬、VTP-850は再発性前立腺癌の治療にデザインされた第2世代免疫療法候補薬である。また、再発性前立腺癌の治療薬として開発された第二世代免疫療法候補化合物VTP-850も含まれている。バリントス・バイオ社の科学的専門性、多様なポートフォリオ、パイプライン開発への注力は、感染症、自己免疫、癌を患う人々の日常生活に大きな影響を与える治療薬を提供するために、同社をユニークな位置づけにしている。詳細はwww.barinthusbio.com。
Forward Looking Statements
このプレスリリースには、1995年米国私募証券訴訟改革法(Private Securities Litigation Reform Act of 1995)の意味における、バリンタス・バイオに関する将来の見通しに関する記述が含まれています。これらの記述は、一般的に、「可能性がある」、「予定である」、「計画である」、「前倒しである」、「奨励する」、「信じる」、「可能性がある」、「期待する」、および同様の表現を使用することにより、そのようなものとして識別することができますが、すべての将来の見通しに関する記述がこれらの識別語を含んでいるわけではありません。これらの将来見通しに関する記述には、製品開発活動や臨床試験を含む当社の将来的な期待、計画、見通しに関する明示的または黙示的な記述が含まれますが、これらに限定されるものではありません。これには、当社プログラムの予備データ、中間データ、最終データの発表時期、VTP-1000のGLU001における最初の患者への投与を含む臨床試験の開始時期、予想される規制当局への申請および承認、現金および現金同等物の予備的な見積もり、資金調達手段、現在および将来の製品候補およびプログラムを開発し前進させる当社の能力などが含まれます。本プレスリリースに記載されている将来の見通しに関する記述は、当社の経営陣の現在の予想および信念に基づくものであり、本プレスリリースに記載されている将来の見通しに関する記述によって表明または暗示されている内容と実際の出来事または結果が大きく異なる原因となり得る数多くのリスク、不確実性、および重要な要因の影響を受けます。これには、当社のパイプライン開発活動および計画中または進行中の臨床試験の成功、コスト、タイミングに関するリスクおよび不確実性(予備データ、中間データ、最終データまたは臨床試験の開始のタイミングが遅れるリスクを含むがこれらに限定されない)が含まれます、当社の戦略実行能力、規制当局の動向、当社の事業資金調達能力および資本調達能力、当社の資金余力(資金余力の見積もりが不正確である可能性を含む)、銀行業界の混乱を含む世界経済の不確実性、ウクライナ紛争、イスラエルおよびガザ紛争、ならびに2023年12月31日を末日とする年度のForm 10-K年次報告書、Form 10-Q四半期報告書およびForm 8-K最新報告書を含む証券取引委員会(以下「SEC」)への提出書類で特定されているその他のリスク。当社は、将来の見通しに関する記述を過度に信頼しないよう注意します。将来の見通しに関する記述は、それらが作成された時点のものです。当社は、将来の見通しに関する記述に記載された予想、または実際の結果が将来の見通しに関する記述に記載されたものと異なる可能性に影響を与える可能性のある事象、状況、または状況の変化を反映するために、かかる記述を公に更新または修正する義務を明示的に否認します。
BARINTHUS BIOTHERAPEUTICS PLC
CONSOLIDATED BALANCE SHEETS
(単位:千米ドル、ただし株式数と一株当たりの金額を除く)
(未監査)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
March 31,2024 |
|
December 31,2023 |
|
| 資産 |
|
|
|
|
| 現金、現金同等物および制限付き現金 |
$ |
129,971 |
|
|
$ |
142,090 |
|
|
| 研究開発報奨金受取額 |
5,196 |
|
|
4,908 |
|
|
| 前払費用およびその他の流動資産 |
7,964 |
|
|
9,907 |
|
|
| 流動資産合計 |
143,131 |
|
|
156,905 |
|
|
| 営業権 |
12,209 |
|
|
12,209 |
|
|
| 有形固定資産(純額) |
11,532 |
|
|
11,821 |
|
|
| 無形資産(純額) |
24,317 |
|
|
25,108 |
|
|
| 使用権資産(純額) |
7,408 |
|
|
7,581 |
|
|
| その他の資産 |
885 |
|
|
882 |
|
|
| 資産合計 |
$ |
199,482 |
|
|
$ |
214,506 |
|
|
| LIABILITIES AND STOCKHOLDERS’ EQUITY |
|
|
|
|
| 現在の負債: |
|
|
|
|
| 買掛金 |
1,162 |
|
|
1,601 |
|
|
| 未払費用およびその他の流動負債 |
8,330 |
|
|
9,212 |
|
|
| Deferred income |
1,434 |
|
|
— |
|
|
| オペレーティング・リース負債-流動負債 |
1,909 |
|
|
1,785 |
|
|
|
|
|
|
|
| 流動負債合計 |
12,835 |
|
|
12,598 |
|
|
| 非流動負債: |
|
|
|
|
| オペレーティング・リース負債-非流動 |
10,897 |
|
|
11,191 |
|
|
| Contingent consideration |
1,867 |
|
|
1,823 |
|
|
| その他非流動負債 |
1,330 |
|
|
1,325 |
|
|
| Deferred tax liability, net |
537 |
|
|
574 |
|
|
| 負債合計 |
$ |
27,466 |
|
|
$ |
27,511 |
|
|
| コミットメントおよび偶発事象(注記15) |
|
|
|
|
| 株主資本の部: |
|
|
|
|
| 普通株式、額面0.000025ポンド、発行可能株式総数38,952,956株(2023年12月31日:発行可能株式総数38,643,540株) |
1 |
|
|
1 |
|
|
| 繰延A株、額面1ポンド、発行可能株式数、発行済株式数:63,443株(2023年12月31日:発行可能株式数、発行済株式数:63,443株) |
86 |
|
|
86 |
|
|
| 資本準備金 |
388,720 |
|
|
386,602 |
|
|
| 累積赤字 |
(192,079) |
|
|
(176,590) |
|
|
| 累積その他の包括損失-外貨換算調整額 |
(24,895) |
|
|
(23,315) |
|
|
| バリントス・バイオセラピューティクス社株主に帰属する株主資本合計 |
171,833 |
|
|
186,784 |
|
|
| 非支配持分 |
183 |
|
|
211 |
|
|
| 株主資本合計 |
$ |
172,016 |
|
|
$ |
186,995 |
|
|
| 負債および株主資本合計 |
$ |
199,482 |
|
|
$ |
214,506 |
|
|
|
|
|
|
|
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要
会社開示情報をすべてご覧になるには株探プレミアムの
会社開示情報をすべてご覧になるには株探プレミアムの登録が必
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧に
Christopher M. Calabrese
Managing Director
+1 917-680-5608
ccalabrese@lifesciadvisors.com
Kevin Gardner
Managing Director
+1 617-283-2856
kgardner@lifesciadvisors.com
Audra Friis
+1 917-519-9577
audrafriis@sambrown.com
Jonothan Blackbourn
IR & PR Manager
Barinthus Bio
ir@barinthusbio.com