UNITED STATES
SECURITIES AND EXCHANGE COMMISSION
Washington, D.C. 20549
FORM 8-K
現行レポート
1934年米国証券取引所法第13条または第15条(d)に基づき
報告日(最も古いイベントの報告日):2025年5月15日
ランタン・ファーマ
(定款に明記された登録者の正確な名称)
| デラウェア | 001-39318 | 46-3973463 | ||
|
(State or Other Jurisdiction of Incorporation) |
(Commission File Number) |
(IRS Employer Identification No.) |
|
1920 マッキニー通り7階 Dallas, Texas |
75201 | |
| (主要経営陣の住所) | (Zip Code) |
(972) 277-1136
(登録者の電話番号(市外局番を含む)
フォーム8-Kの提出が、以下のいずれかの規定(以下の一般的説明A.2.を参照)に基づく登録者の提出義務を同時に満たすことを意図している場合は、以下の該当するボックスにチェックしてください:
| ☐ | 証券法に基づく規則425に従った書面によるコミュニケーション(17 cfr 230.425) |
| ☐ | 取引所法の下でのルール14a-12(17 cfr 240.14a-12)に基づく資料の勧誘。) |
| ☐ | 取引所法の規則14d-2(b)に基づく開始前のコミュニケーション(17 cfr 240.14d-2(b)) |
| ☐ | 証券取引法の規則13e-4(c)に基づく開始前のコミュニケーション(17 cfr 240.13e-4(c)) |
法第12条(b)に基づき登録された証券:普通株式
| Title of each class | Trading Symbol | 登録されている各取引所の名称 | ||
| 普通株式、額面0.0001ドル | LTRN | ナスダック株式市場 |
登録者が1933年証券法規則405(本章230.405節)または1934年証券取引法規則12b-2(本章240.12b-2節)で定義される新興成長企業であるかどうかをチェックマークで示す。
Emerging growth company ☒
新興成長企業の場合、登録者が取引所法第13条(a)に従い提供される新規または改訂された財務会計基準に準拠するための延長された移行期間を使用しないことを選択した場合は、チェックマークで示すこと。☒ 2025 年 5 月 15 日、ランタンファーマ株式会社(以下「当社」)は、2025 年 3 月 31 日に終了する第 1 四半期の決算を発表するプレスリリースを発表します。プレスリリースのコピーは、本フォーム 8-K の別紙 99.1 として提出され、参照することにより本書に組み込まれます。
Item 2.02 営業成績および財務状況
本項目2.02に記載された情報は、別紙99.1を含め、改正1934年証券取引法(以下「取引所法」)第18条において「提出」されたものとはみなされず、また同条の適用を受けるものでもなく、1933年証券取引法(以下「改正証券取引法」)または取引所法に基づく提出書類において、当該提出書類における一般的な組み込み文言にかかわらず、当該提出書類において明示的に特定の参照により組み込まれない限り、参照により組み込まれたものとはみなされないものとする。
Item 7.01 Regulation FD Disclosure
2025年5月15日、当社は、2025年3月31日に終了する第1四半期の財務および営業成績について、当社主催の電話会議およびライブ・ウェビナーにおいて、当社の議論を支援するためのプレゼンテーションを活用する予定です。同プレゼンテーションのコピーは本フォーム8-Kカレント・レポートの別紙99.2として提出され、参照することによりここに組み込まれる。
本項目7.01に記載された情報は、別紙99.2を含め、改正1934年証券取引法(以下「取引所法」)第18条において「提出」されたものとはみなされず、また同条の適用を受けるものでもなく、1933年証券取引法(以下「1933年証券取引法」)または取引所法に基づく提出書類において、当該提出書類における一般的な組み込み文言にかかわらず、当該提出書類において明示的に特定の参照により組み込まれない限り、参照により組み込まれたものとはみなされないものとします。
Item 9.01 財務諸表および添付資料
(d) 出展物
| Exhibit No. | Exhibit Description | |
| 99.1 | 2025年5月15日付プレスリリース(2025年3月31日終了四半期決算発表)。 | |
| 99.2 | 2025年5月15日、2025年3月31日に終了した四半期の財務および営業成績に関する電話会議およびライブ・ウェビナーに関するプレゼンテーション。 | |
| 104 | 表紙 インタラクティブ・データ・ファイル(インライン xbrl 形式、別紙 101 に記載)。 |
|
|
SIGNATURES
1934年証券取引法の要件に従い、登録者は本報告書に正式に権限を付与された署名者により、登録者を代表して署名させた。
| Lantern Pharma Inc., | ||
| A Delaware Corporation | ||
| Dated: May 15, 2025 | By: | /s/ David R. Margrave |
| デビッド・r・マーグレイブ 最高財務責任者(cfo | ||
|
|
Exhibit 99.1

ランタン・ファーマ、2025年第1四半期決算と事業最新情報を発表
| ● | 2025年6月末までに、さまざまな固形がん患者62~65人を対象としたLP-184第1a相臨床試験の登録が完了する予定。 | |
| ● | 2025年第3四半期に、非小細胞肺がんの未喫煙者を対象としたLP-300を評価するHARMONIC™試験の追加患者データの読み出しが予定されており、これにはアジア拡大コホートの患者の最初の読み出しも含まれる。 | |
| ● | 独自の血液脳関門透過予測特許をPCT出願し、AIの知的財産ポートフォリオを強化。 | |
| ● | 抗体薬物複合体(ADC)開発の精度、コスト、スケジュールを改善する革新的なAI搭載モジュールを備えたRADR®プラットフォームを拡張し、ターゲット、ペイロード、腫瘍選択性を設計・最適化する独自のアルゴリズムを用いたマルチオミクス・アプローチを統合。 | |
| ● | 抗がん剤開発におけるオープンソースイノベーションを促進するため、科学・研究コミュニティ向けにRADR®AIモジュールの商業的利用および発売を計画。 | |
| ● | ジョンズ・ホプキンス大学の共同研究者により、ATRT のような希少な小児脳腫瘍における LP-184 の過敏性が前臨床試験で確認され、中枢神経系腫瘍を対象とした小児臨床試験が計画されています。 | |
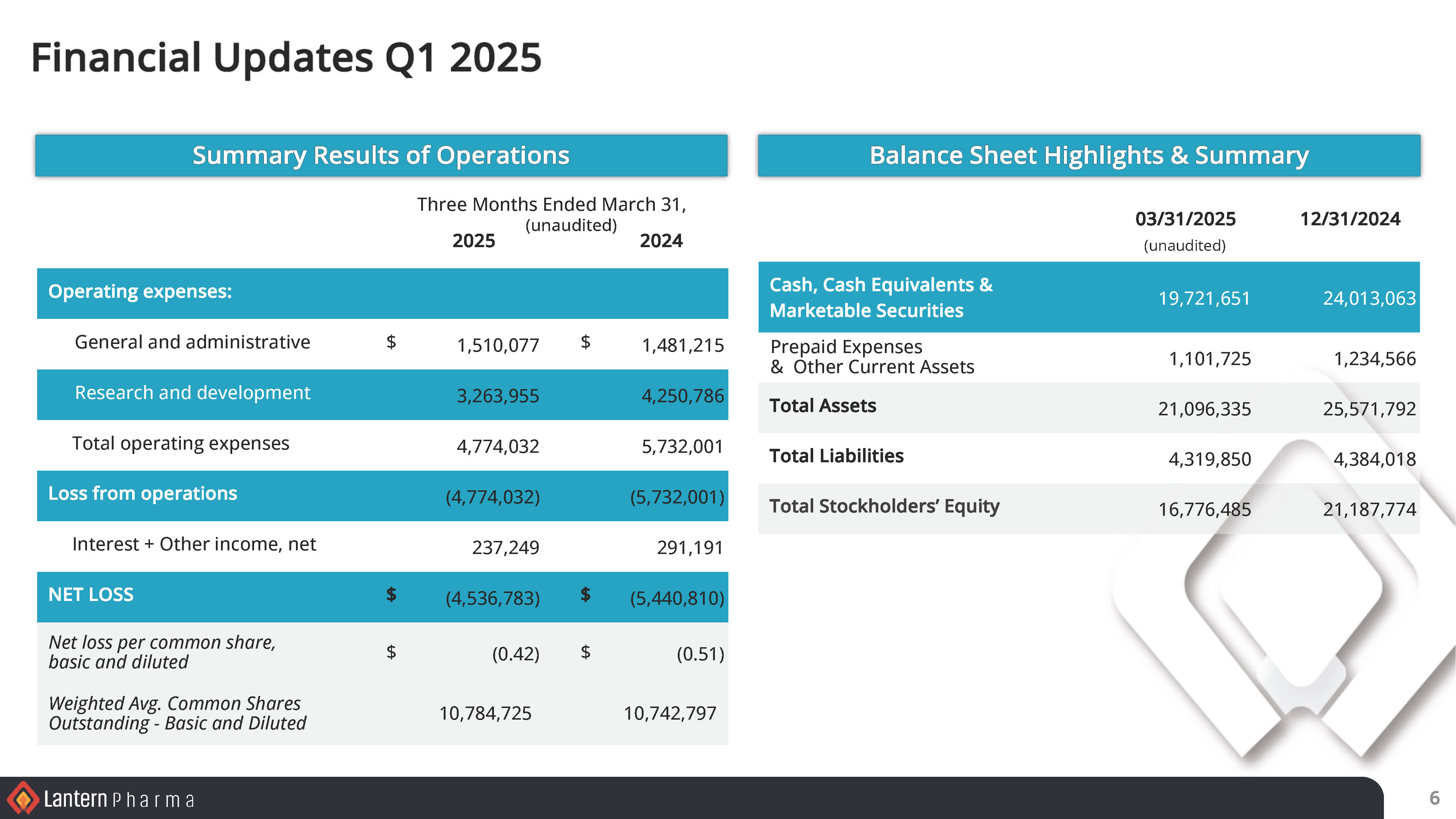
| ● | 規律ある資本管理を維持し、2025年3月31日現在、約1970万ドルの現金、現金同等物および有価証券があり、少なくとも2026年5月15日までの営業運転資金が期待できる。 | |
| ● | 電話会議とウェブキャストは2025年5月15日(木)午前9時(東部標準時)に予定されている。 |
FOR IMMEDIATE RELEASE
ダラス-(BUSINESS WIRE)-2025年5月15日-ランタン・ファーマ・インク(NASDAQ: LTRN)は、独自のRADR®人工知能(AI)および機械学習(ML)プラットフォームを活用し、コストとペース、タイムラインを変革する臨床段階のバイオ医薬品企業です。(NASDAQ:LTRN)は本日、独自のRADR®人工知能(AI)および機械学習(ML)プラットフォームを活用し、がん領域の創薬および薬剤開発のコスト、ペース、タイムラインを変革する臨床段階のバイオ医薬品企業として、2025年3月31日を期末とする2025年度第1四半期の業務ハイライトと財務業績を発表し、AIを活用した薬剤候補のポートフォリオ、がん領域の薬剤開発を精密に強化するRADR®プラットフォーム、その他の業務進捗に関する最新情報を提供しました。
| www.lanternpharma.com | 2025年第1四半期ランタンファーマ決算プレスリリース&最新情報 | pp. |

「今四半期は、当社の臨床および技術開発において極めて重要な転換点となります。LP-184 第 1a 相試験の登録が完了し、LP-300 ハーモニック試験の追加データ(アジア拡大コホートの初期デー タを含む)の読み出しに向けた準備を進める中で、当社は潜在的なバイオファーマ・パートナーとの生産的な 議論に向けた態勢を整えつつあります。同時に、当社のRADR®AIプラットフォームは、数千億のデータポイントを活用した広範かつ有効なオンコロジー医薬品開発モジュールにより、重要な開発マイルストーンに到達しました。これらの進歩は、患者さんと株主の皆様に価値を提供することに焦点を当てた商業化に向けた明確な道筋を確立しながら、現実に満たされていない患者さんのニーズに対応することに重点を置いた、当社の抗がん剤開発に対するAI主導のアプローチをさらに実証するものです。"-パナ・シャルマ、ランタン・ファーマCEO兼社長
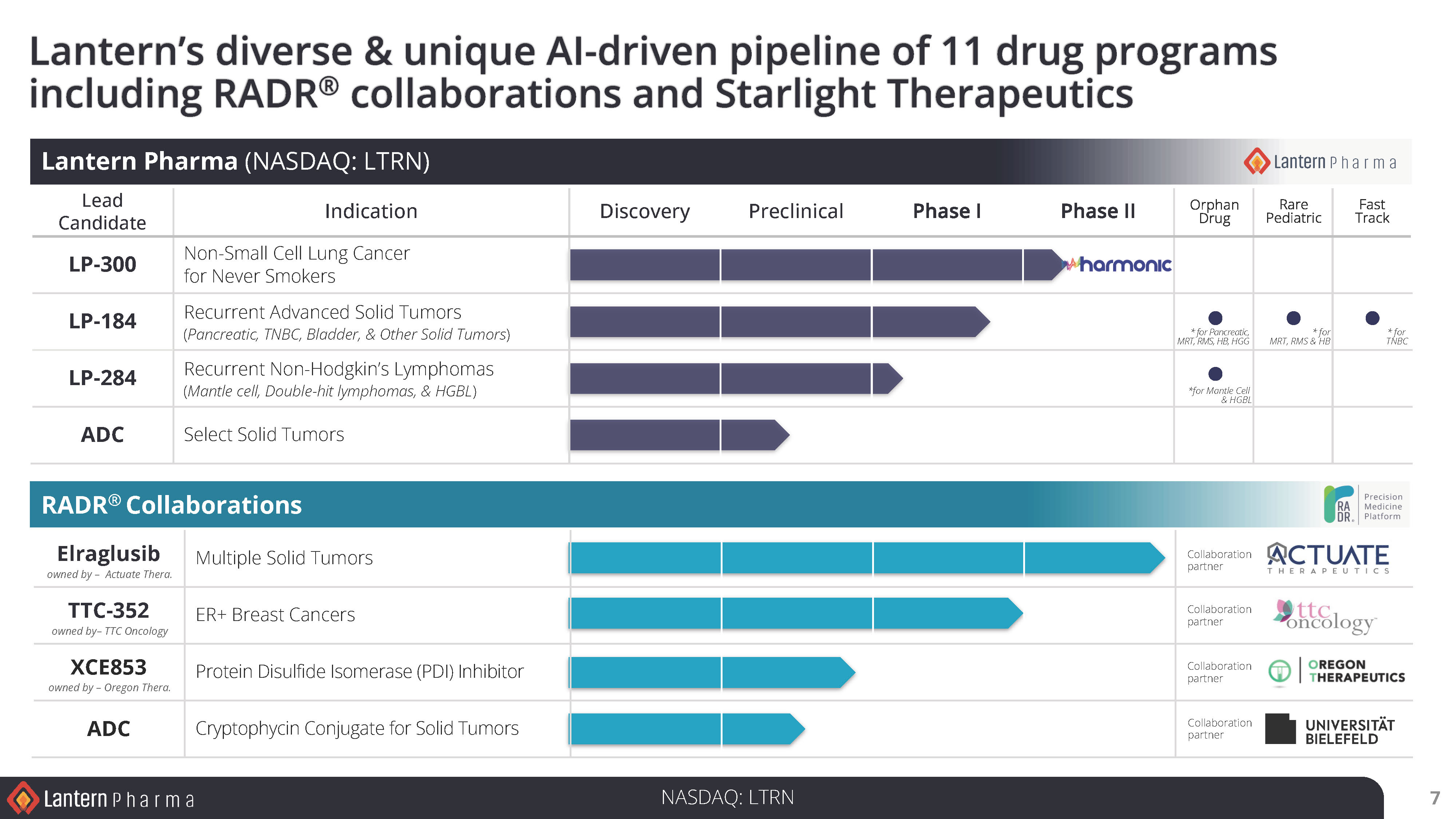
AIを活用した医薬品開発パイプラインのハイライト:
LP-300
ランタンの LP-300 の第 2 相 HARMONIC™ 試験は 2025 年第 1 四半期も進行し、日本と台湾で患者が登録され、米国でも登録が進行中である。米国では新規 NSCLC 症例の約 15%を喫煙歴のない患者が占めているのに対し、東アジアでは NSCLC の新規症例の約 33%から 40%を喫煙歴のない患者が占めています。LP-300は、TKI治療後に進行したNSCLC腺癌の非喫煙者を対象に、標準化学療法(カルボプラチン+ペメトレキセド)との併用で評価される。本試験は、米国および東アジアで約90名の患者を登録する予定である。
第2相臨床結果米国で実施された第2相安全性試験(リードインコホート)の予備データでは、臨床的有効率は86%、客観的奏効率は43%であった。拡大コホートからの追加患者データは、現時点では、同様の患者の奏効率と臨床的有益率の傾向を引き続き支持している。ランタンは、2025年第3四半期中に、リードインコホートに登録された患者からの最新データおよびアジア拡大コホートに登録された患者からの新たなデータを含む追加結果を発表する予定である。
LP-184
LP-184は、2025年6月中の登録終了を目標に、複数の固形がんを対象としたフェーズ1a試験で前進を続けている。LP-184は、GBM(多形膠芽腫)およびTNBC(トリプルネガティブ乳がん)に対してFDAからファスト・トラック指定を受けた。さらに、LP-184は肝芽腫、横紋筋肉腫、悪性横紋筋肉腫、ATRT(非定型奇形横紋筋肉腫)の4つの小児希少疾病指定を受けています。
フェーズ1aの結果:安全性、忍容性、MTD決定を含む薬物動態 - 臨床試験は現在コホート12まで登録されており、予備的なPKデータと一致して、臨床活性の初期兆候が高用量レベルで観察されている。2025 年第 1 四半期中、安全性審査委員会(SRC)は当社とともに、試験参加者の安全性を確保し、今後の LP-184 臨床試験の指針となる臨床活性を評価しつつ、最大耐容量(MTD)を明確にするため、用量レベル 10 および 11 をバックフィルすることを決定しました。投与量レベル9以上の登録は、DNA損傷修復変異が確認された進行固形がん患者の組み入れに重点を置いています。より広範な臨床データの更新は2025年第3四半期に予定されており、バイオマーカー相関とともに、安全性、薬物動態、用量反応に関する完全なデータが入手可能となる見込みである。
今後予定されているフェーズ1b/2試験:ランタンは最近、薬事承認に向けた道筋を示すことができる2つの臨床試験プロトコルをFDAにクリアした。
最初の試験は、5 月 5 日に発表された TNBC を対象とした第 1b/2 相試験で、LP-184 を PARP 阻害剤オラパリブとの併用療法と単剤療法の両方で評価するものです。FDAはプロトコールに異論を唱えておらず、ランタンは、臨床的優先順位と資金調達次第で、米国とナイジェリアとインドの主要学術がんセンターでこの試験を開始する予定です。新たに診断された転移性TNBCの平均生存期間は8~13カ月と推定され、年間40億米ドルを超える市場機会がある。
| www.lanternpharma.com | 2025年第1四半期ランタンファーマ決算プレスリリース&最新情報 | pp. |

2つ目は5月12日に発表されたもので、STK11および/またはKEAP1遺伝子に変異を有する薬剤抵抗性非小細胞肺がんのバイオマーカーで定義されたサブセットを対象としたフェーズ1b/2試験である。このユニークな臨床試験は、肺がん治療における重大なアンメット・クリニカル・ニーズに対処することを目的としている。KEAP1および/またはSTK11遺伝子変異を有する新規診断の進行NSCLC患者において化学免疫療法を受けた場合の全生存期間中央値は平均15カ月であり、遺伝子変異陰性集団の治療成績よりも大幅に低い。早期の治療法に失敗した患者の全生存期間は約6.3ヵ月とさらに低い傾向にある。これらの変異を有する患者の有病率と予後不良を考えると、これは年間20億ドルを超える市場機会を意味する。
さらに、再発膀胱癌に対する LP-184 の医師主導の探索的臨床試験が 2025 年第 3 四半期にデンマークで開始される予定です。この臨床試験は、特に DNA 損傷修復変異を有する進行再発膀胱癌患者を対象に、LP-184 を単剤で試験するものであり、3rd ラインでの使用を支持するデータへの道筋をつける可能性があります。
RADR® A.I. Platform:
ランタン独自のRADR®プラットフォームは、2025年第1四半期中に、腫瘍学、分子生物学、臨床、生化学、前臨床データセットの複数のソース(独自、共同、公開)にまたがる、腫瘍学に焦点を当てた約2,000億データポイントまで成長した。
RADR®は、その進歩において重要な役割を果たし続けている:
| ● | drug candidate optimization, | |
| ● | 臨床的に適切な薬剤候補の組み合わせの開発と検証, | |
| ● | 作用機序の特定, | |
| ● | 新薬候補の最適な適応症の特定, | |
| ● | 患者選択をサポートするバイオマーカーシグネチャーの作成, | |
| ● | 分子特性の最適化と特性評価 | |
| ● | 分子の血液脳関門(BBB)ポテンシャルの予測。 |
AIとプラットフォーム主導の洞察は、患者層別化を導くPTGR1のqPCRアッセイを含むLP-184の臨床バイオマーカー戦略に貢献し、希少小児疾患の指定につながる複数の適応症の特定を支援しました。さらに、RADR® は、LP-184 と PARP 阻害剤、LP-284 とリツキシマブなどの併用戦略も支えています。将来的な計画や開発案としては、成人および小児がんを対象とした主要ながん開発グループやバイオ製薬企業とのさらなる提携があります。例えば、分子のBBB透過性を含む特定の分子特性の予測、分子または薬剤候補に対してより高い感受性を示す可能性が高い潜在的な癌適応症の同定、希少癌における分子の潜在的な治療有用性を実証するための最適化された経路の開発支援などです。
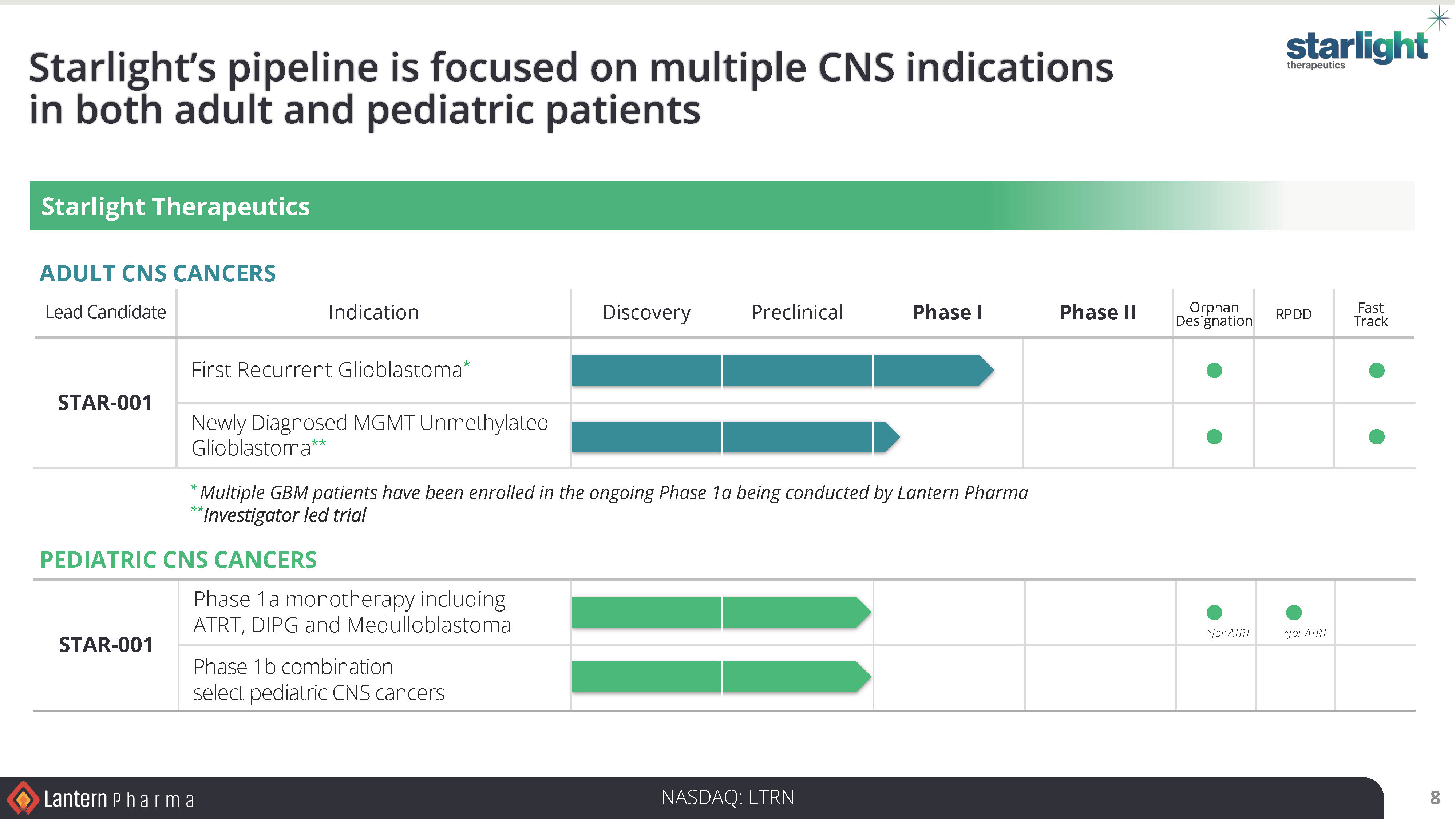
Starlight Therapeutics:
ランタンの完全子会社で中枢神経系および脳腫瘍に特化したスターライト・セラピューティクスは、STAR-001の医師主導臨床試験の可能性を含め、成人および小児臨床試験のデザイン、開発、承認に向けて重要な進展を遂げた。中枢神経系を適応症とするSTAR-001と呼ばれるLP-184は、神経腫瘍学会(SNO)2024年会議で注目され、再発性GBMを対象とするフェーズ1b/2試験は、追加資金調達とプロトコールのクリアランスが成功すれば、2025年後半に開始される予定である。さらに、ランタン社のジョンズ・ホプキンス大学の共同研究者が主導する前臨床試験により、希少な小児脳腫瘍における LP-184 の過敏性が独自に確認され、中枢神経系腫瘍を対象とする小児コンソーシアムとの臨床試験が計画されています。

会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料
会社開示情報をすべてご覧になるには株探
会社開示情報をすべてご覧になるには株探プレミ
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施

会社開示情報をすべてご覧になるには株探プレミアムの登録が
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧
会社開示情報をすべてご覧になるには株探
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無
会社開示情報をすべてご覧になるには株探プレ
Investor Relations
会社開示情報をすべてご覧になるには株探プレ
会社開示情報をすべてご覧になる
###
会社開示情報をすべてご覧に