Document
アブスキー社、事業の最新情報と2025年第1四半期の財務・業績について発表
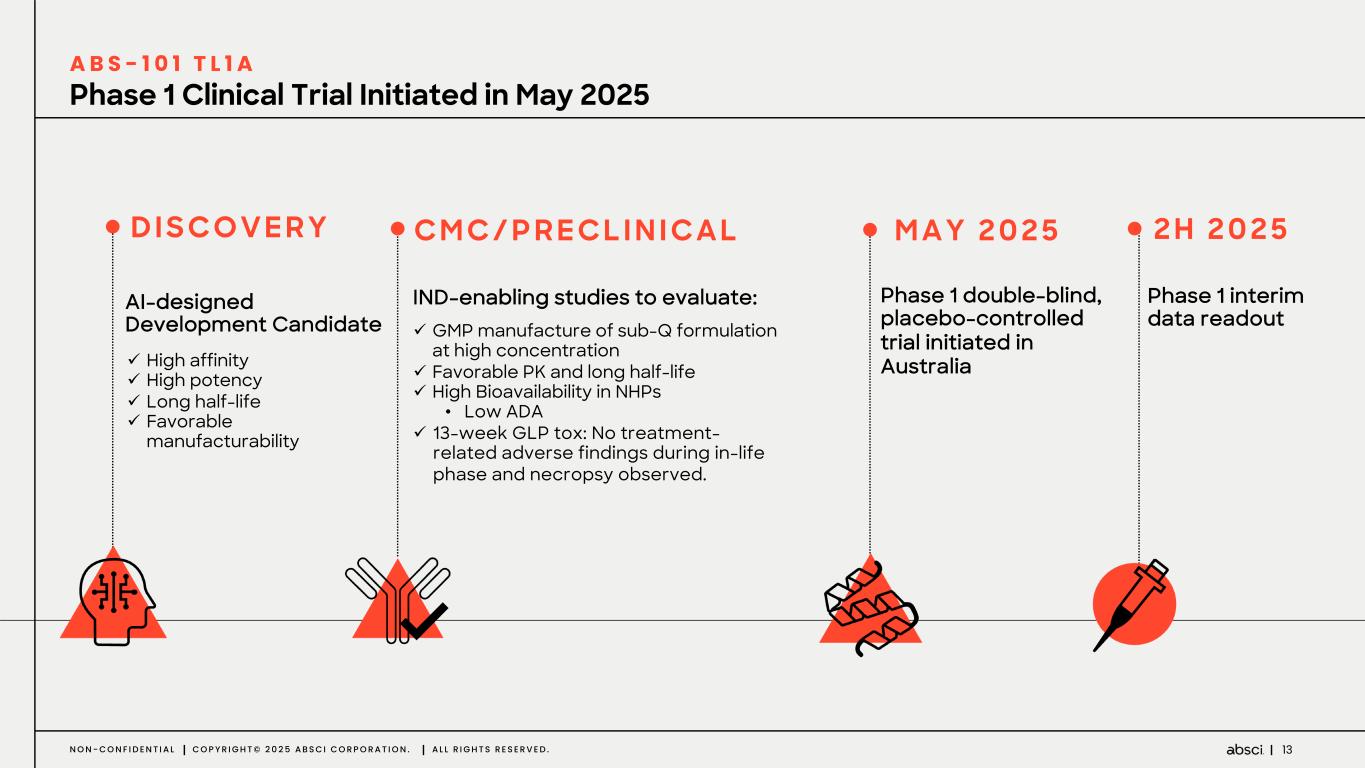
ABS-101(抗TL1A抗体)のファースト・イン・ヒューマン試験の被験者への投与を開始。
ABS-201(抗PRLR薬)の非ヒト霊長類(NHP)データにより、半減期の延長と高い皮下バイオアベイラビリティを証明。
2027年前半までの事業運営に十分な現金、現金同等物および短期投資
アブシティ・コーポレーション(Nasdaq: ABSI)は本日、2025年3月31日に終了した四半期決算と営業成績を発表した。
「創業者兼CEOのショーン・マクレーンは、「ABS-101のヒト初試験の開始は、Absciが臨床段階のバイオテクノロジー企業に移行したことを正式に示すものであり、ABS-201も来年早々の臨床開始に向けて加速しています。「完全自社開発、提携開発、共同開発プログラムのポートフォリオを引き続き実行し、新たな提携も視野に入れながら、本年中、そしてそれ以降も、極めて重要な最新情報をお伝えできるものと期待しています。
Recent Highlights
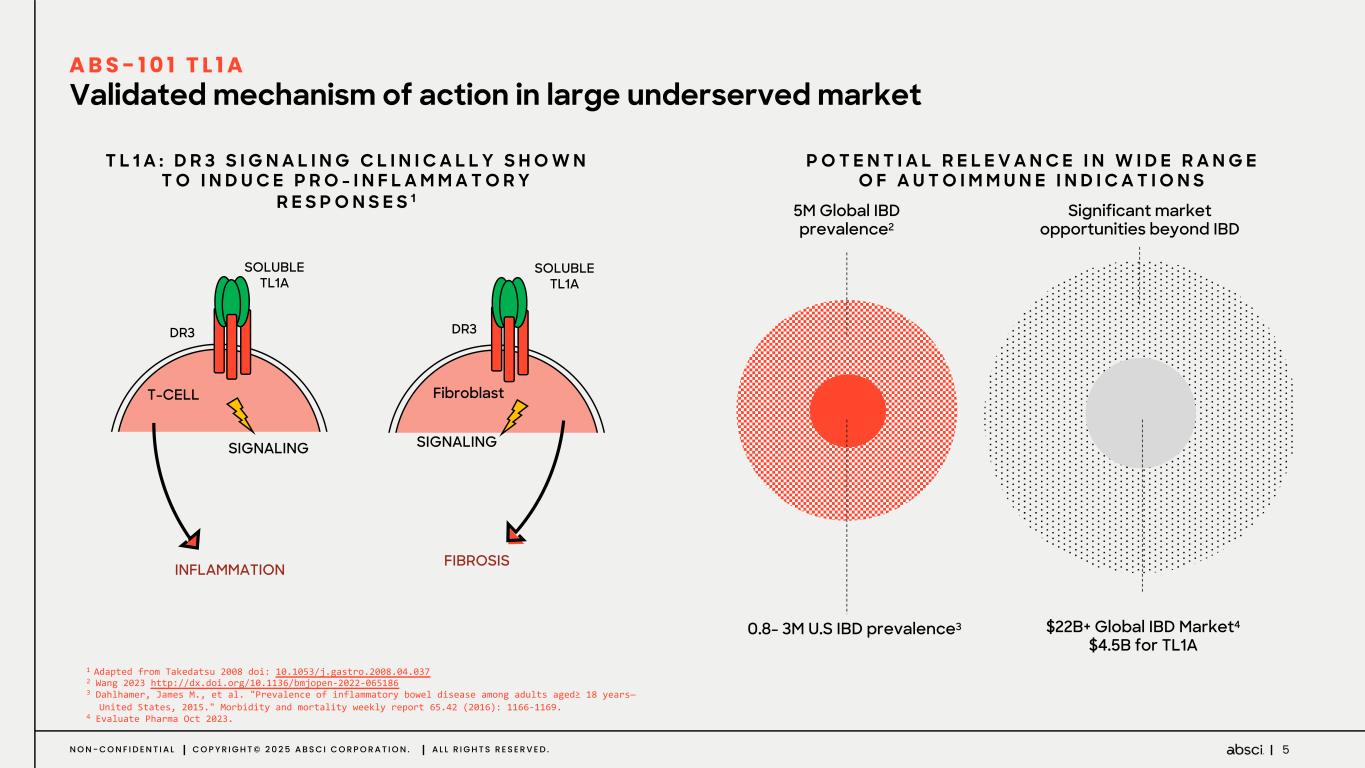
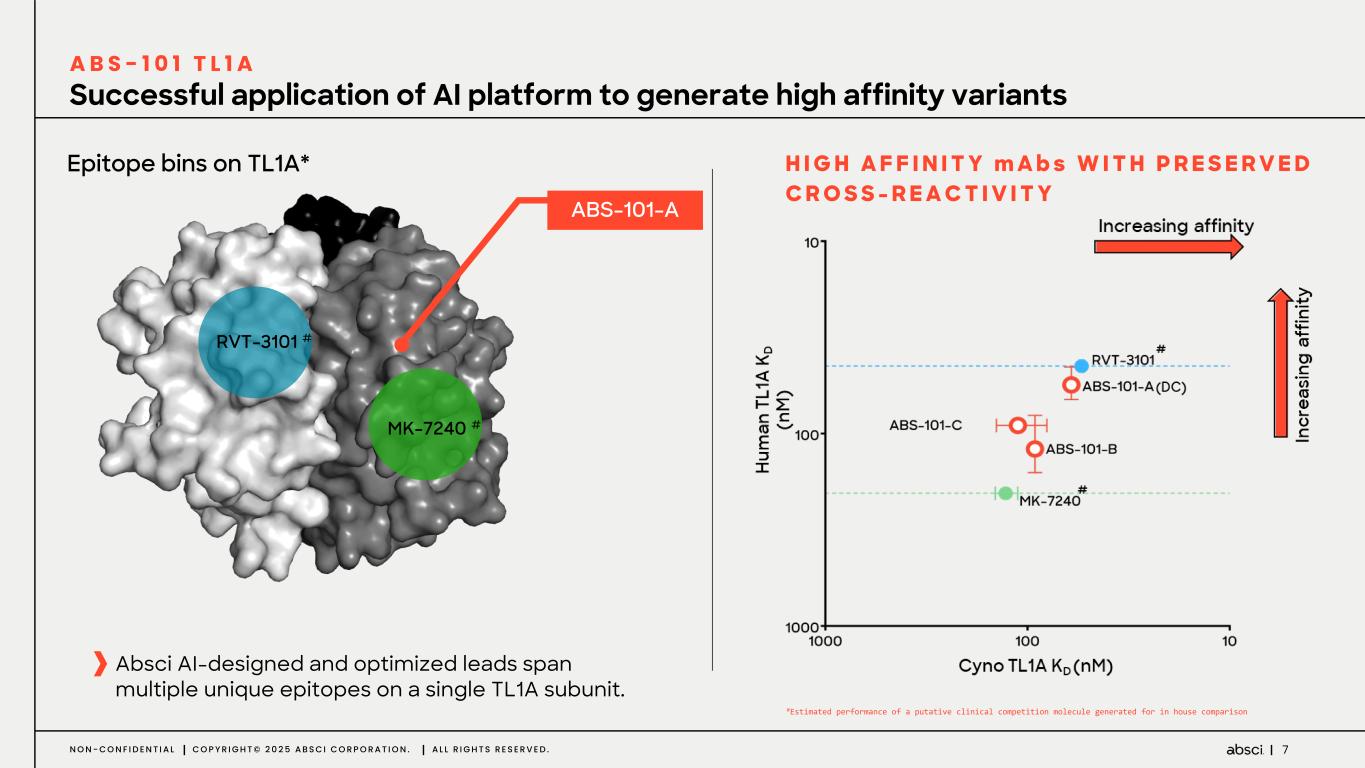
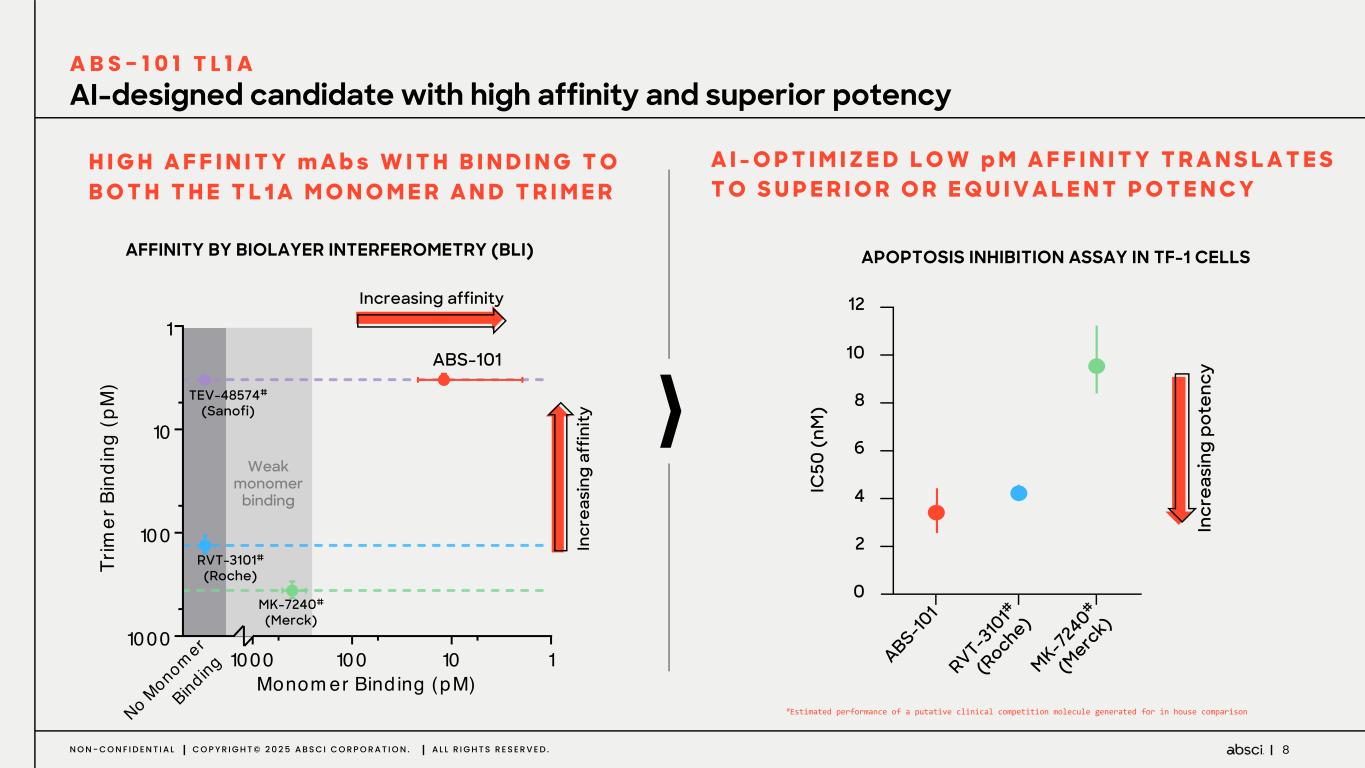
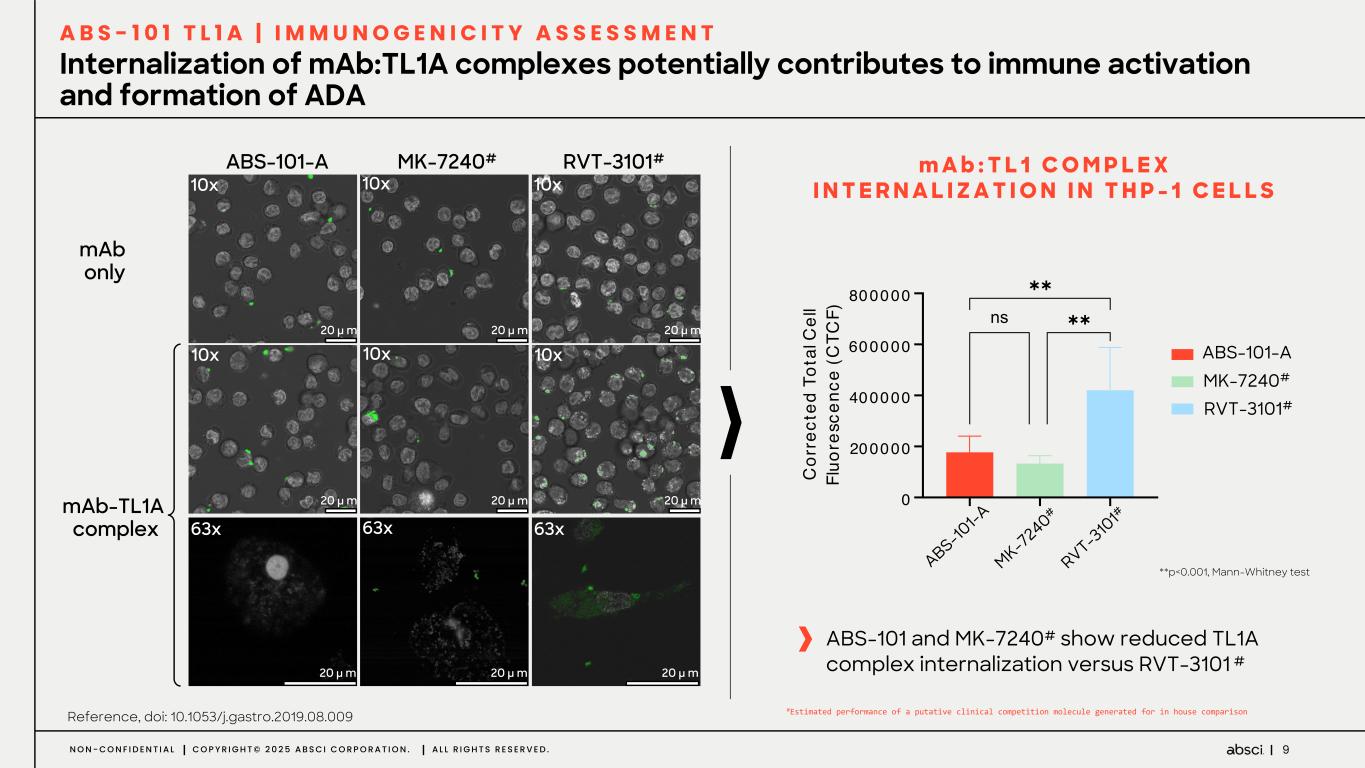
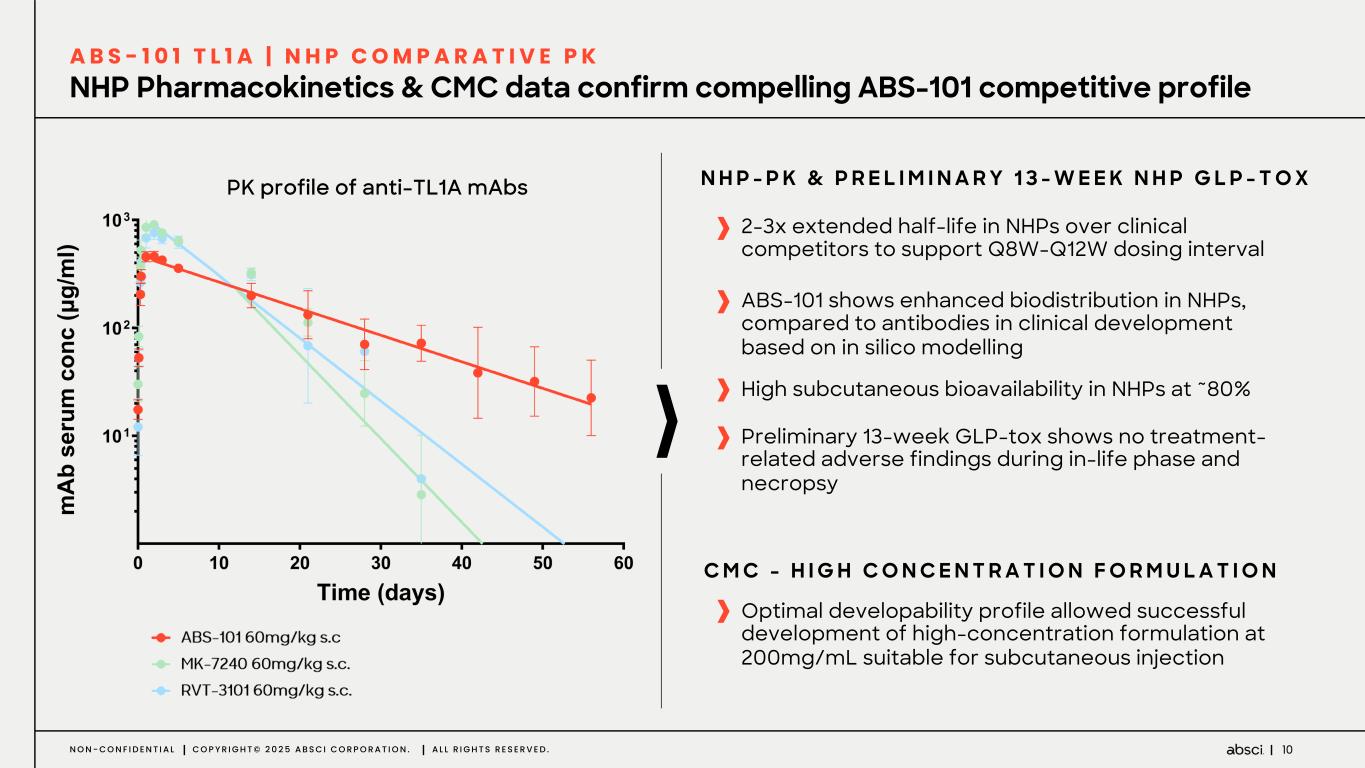
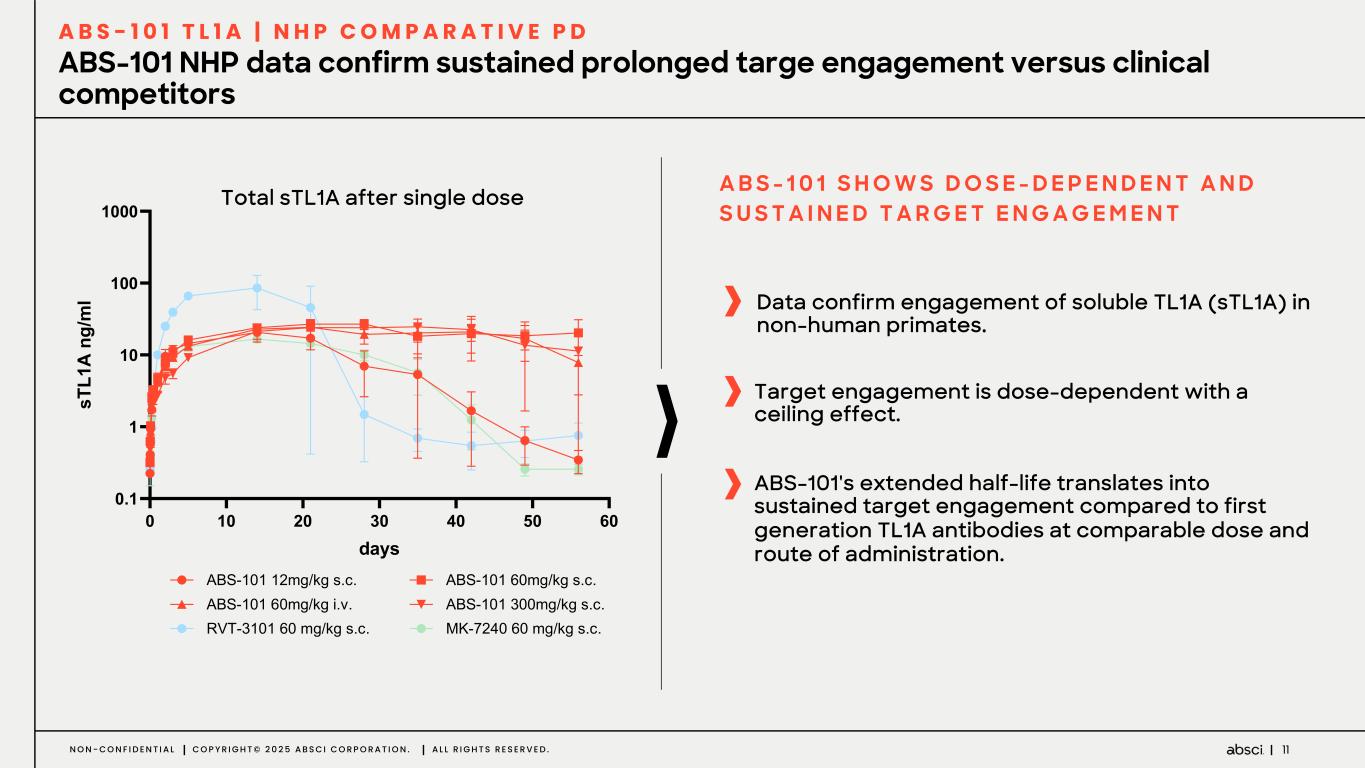
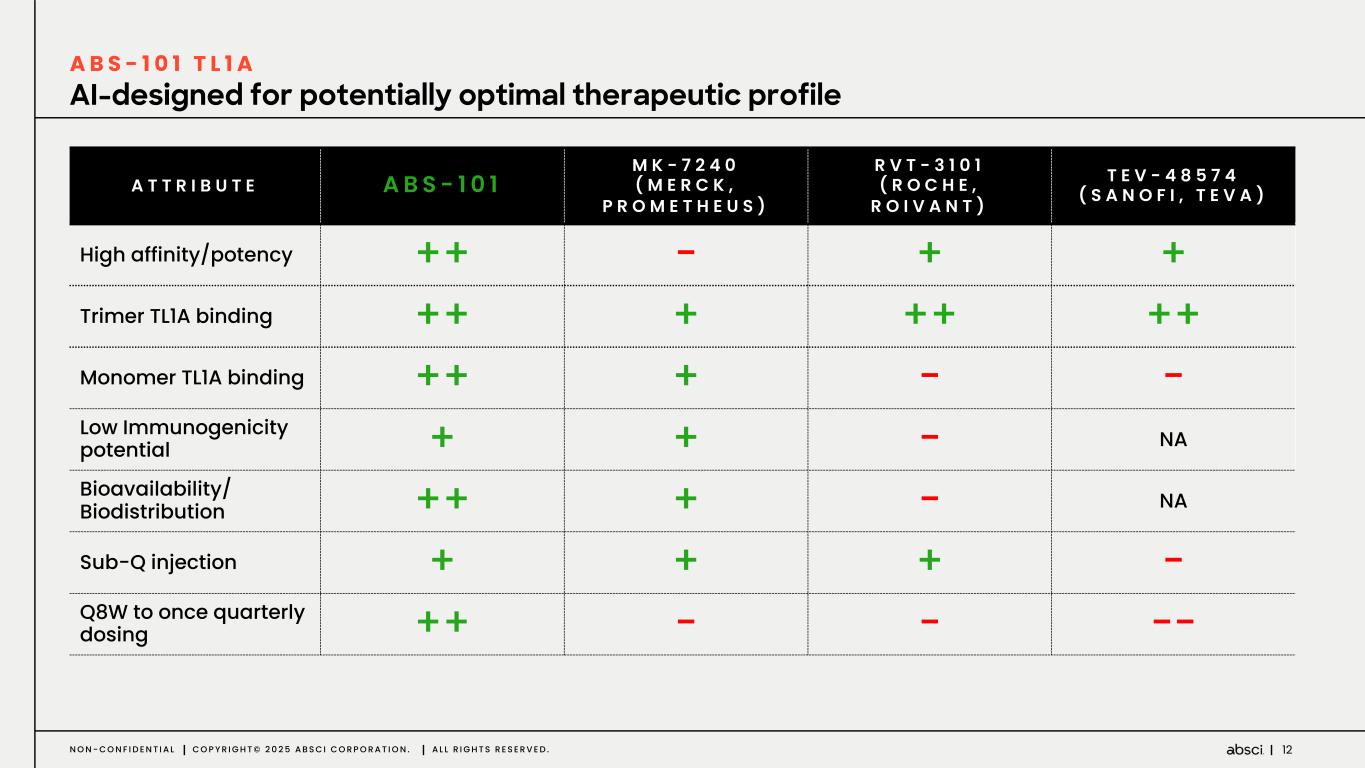
-クラス最高の抗TL1A抗体となる可能性のあるABS-101のファースト・イン・ヒト試験の被験者の投与を開始。Absci社は、現在進行中の試験の中間データを2025年後半に報告する予定。
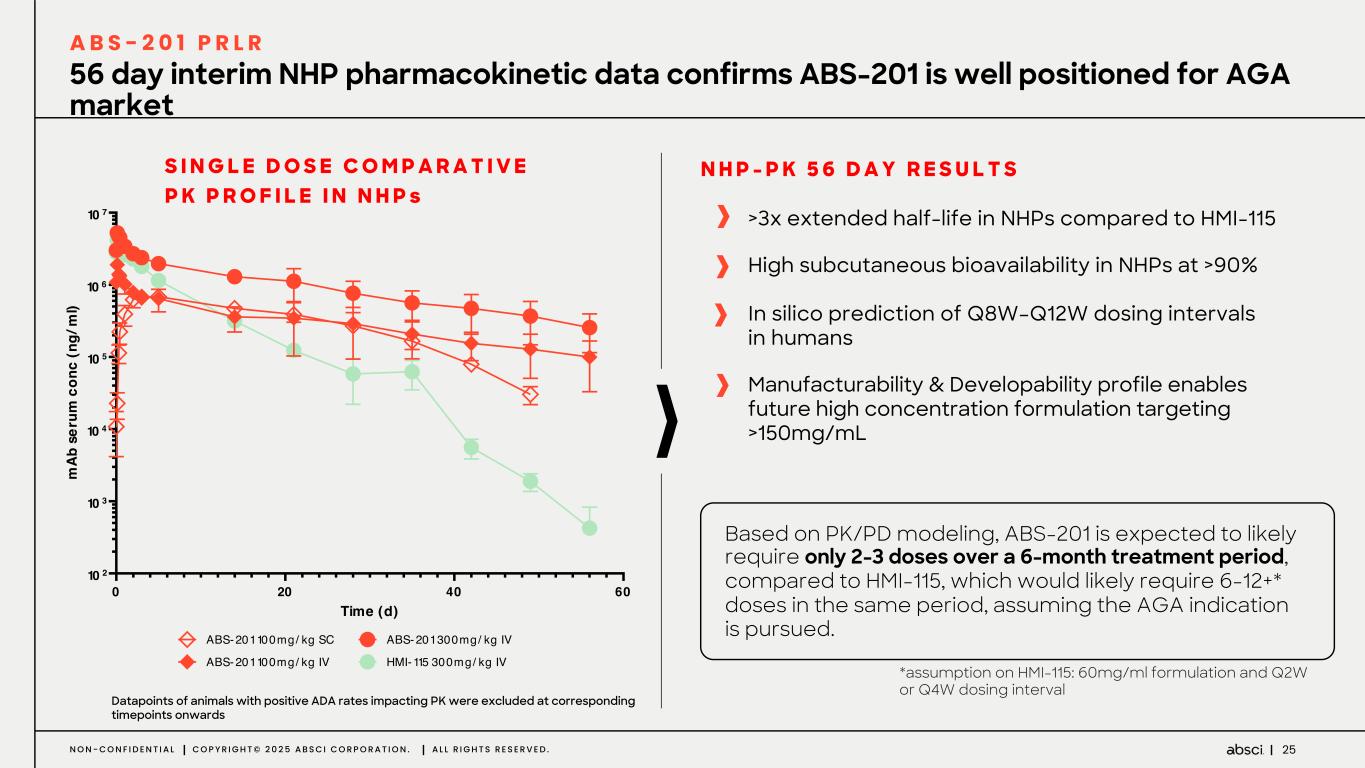
-ABS-201(抗PRLR)アンドロゲン性脱毛症プログラムのNHPデータを発表:
半減期の延長により、ヒトでの投与間隔がQ8W-Q12Wになる可能性がある。
NHPにおける皮下バイオアベイラビリティは90%以上と高い。
将来の150mg/mLを超える高濃度製剤を可能にする、優れた製造可能性と開発可能性のプロファイル
社内パイプラインの最新情報、予想されるプログラムの進捗状況、2025年の見通し
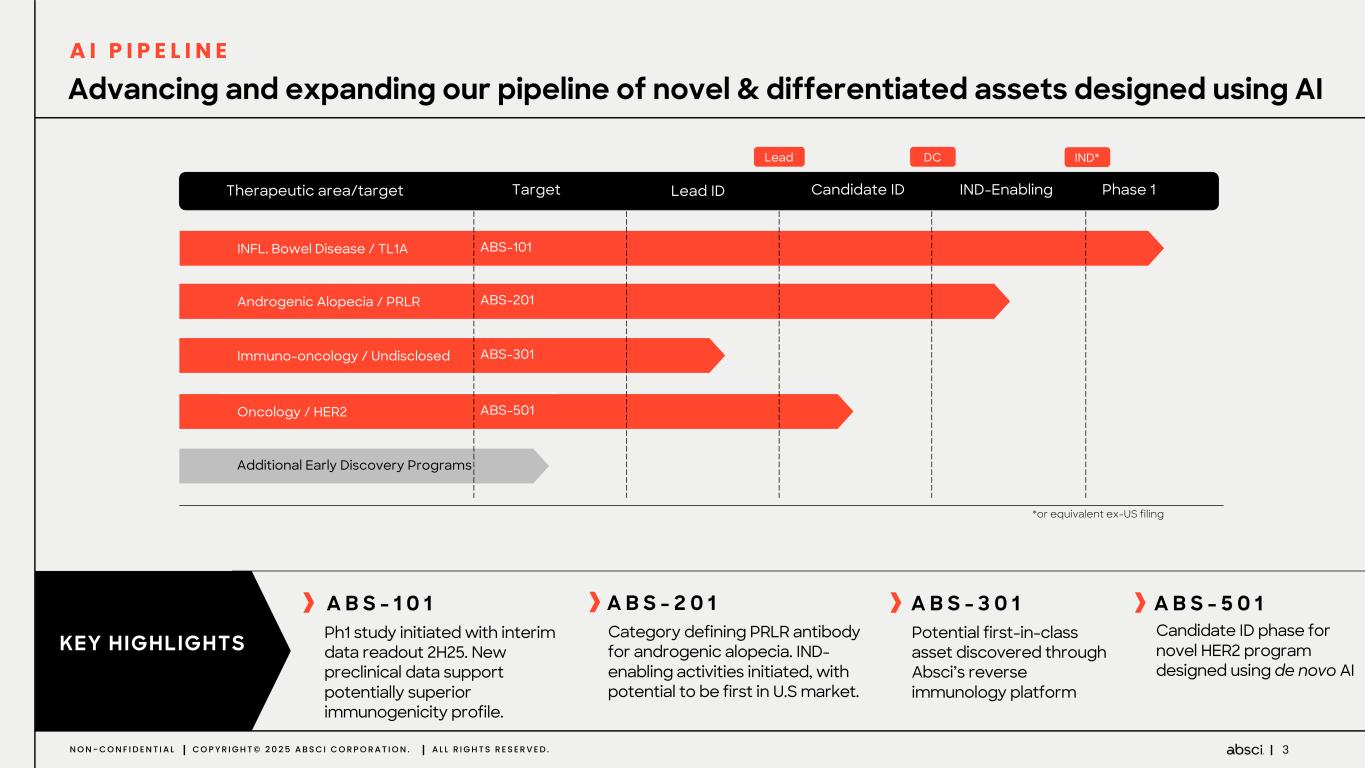
-ABS-101(クラス最高の抗TL1A抗体の可能性):アブシ社は本日、ABS-101 のファースト・イン・ヒト試験の被験者への投与を開始したと発表した。第1相試験(ACTRN12625000212459p)は、ABS-101の単回昇降投与による無作為化二重盲検プラセボ対照ファースト・イン・ヒューマン試験で、健康なボランティアを対象に安全性、忍容性、薬物動態(PK)、薬力学(PD)を評価します。本試験には約40名の健常成人参加者を登録する予定である。主要評価項目は安全性と忍容性で、PK、PD、免疫原性が副次的評価項目となる。フェーズ1の中間データ発表は2025年後半を予定している。
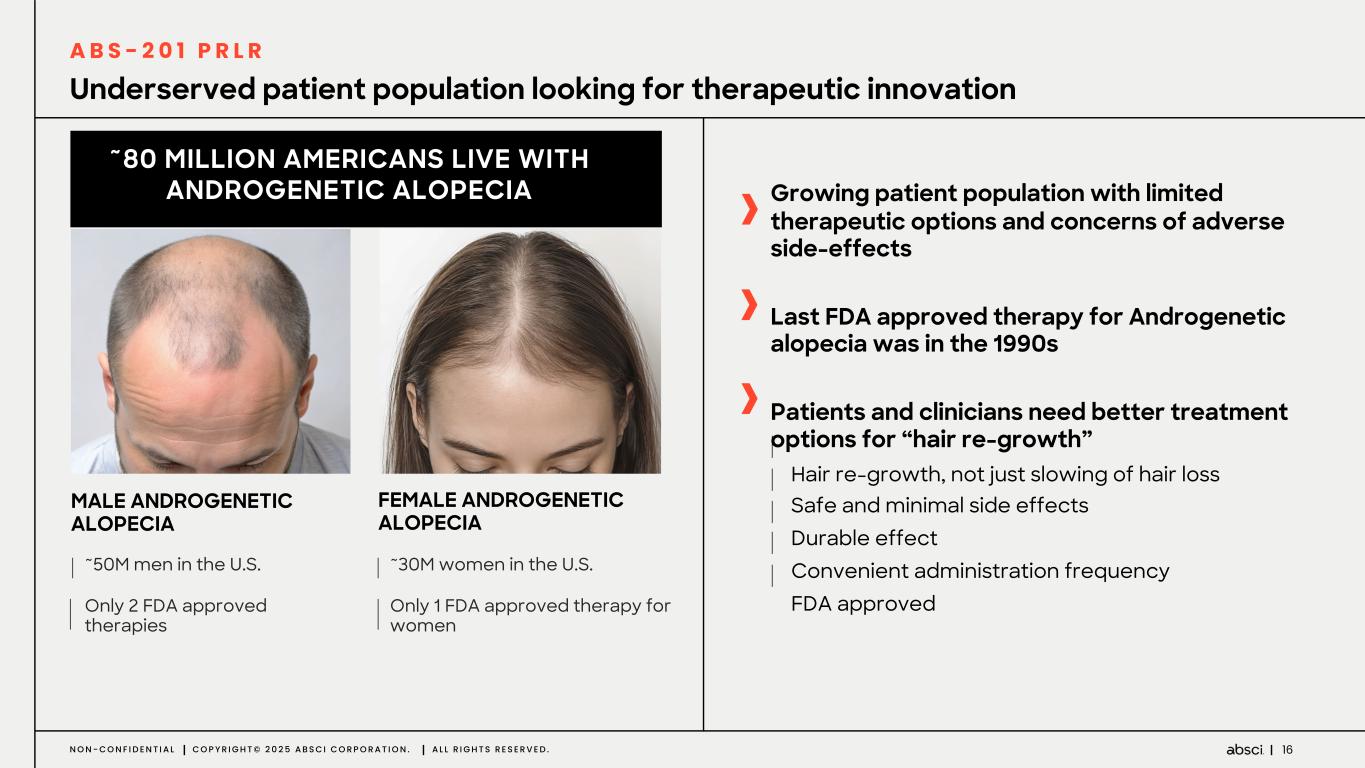
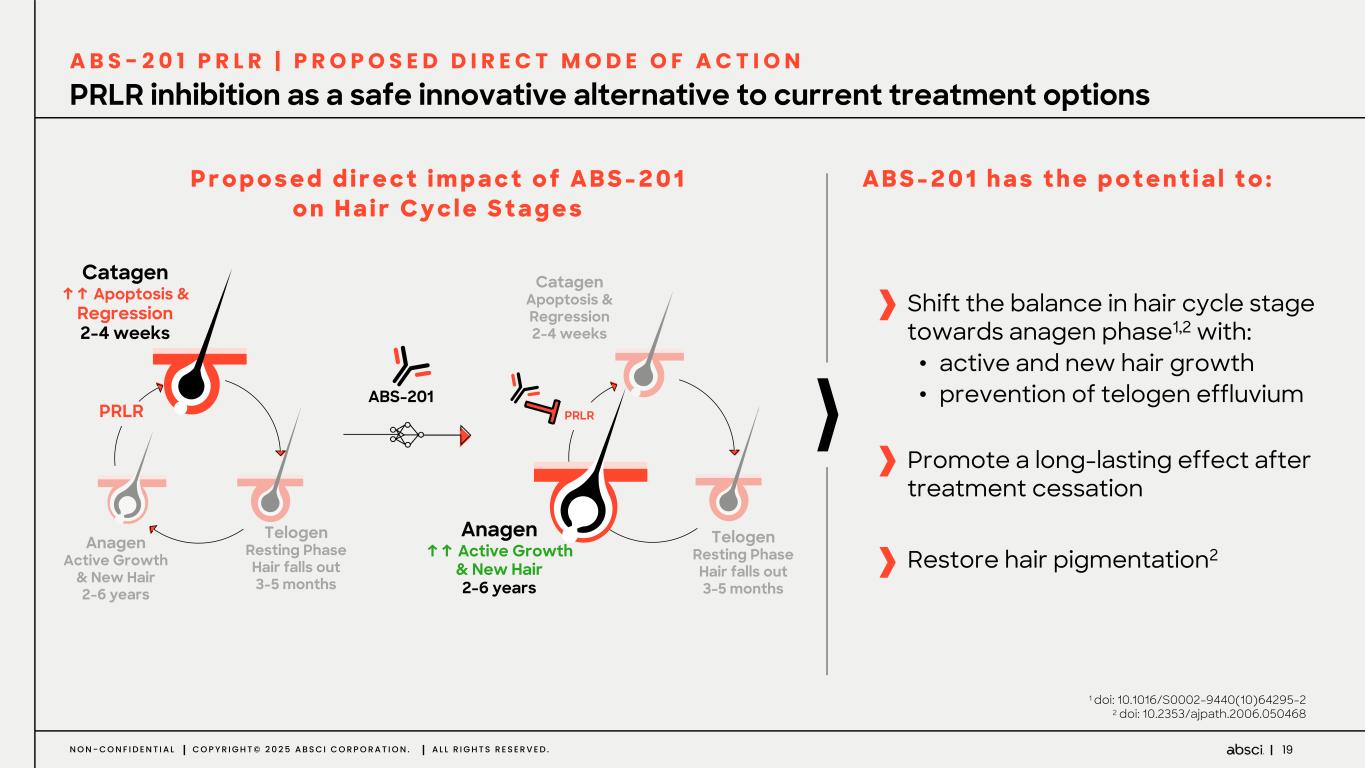
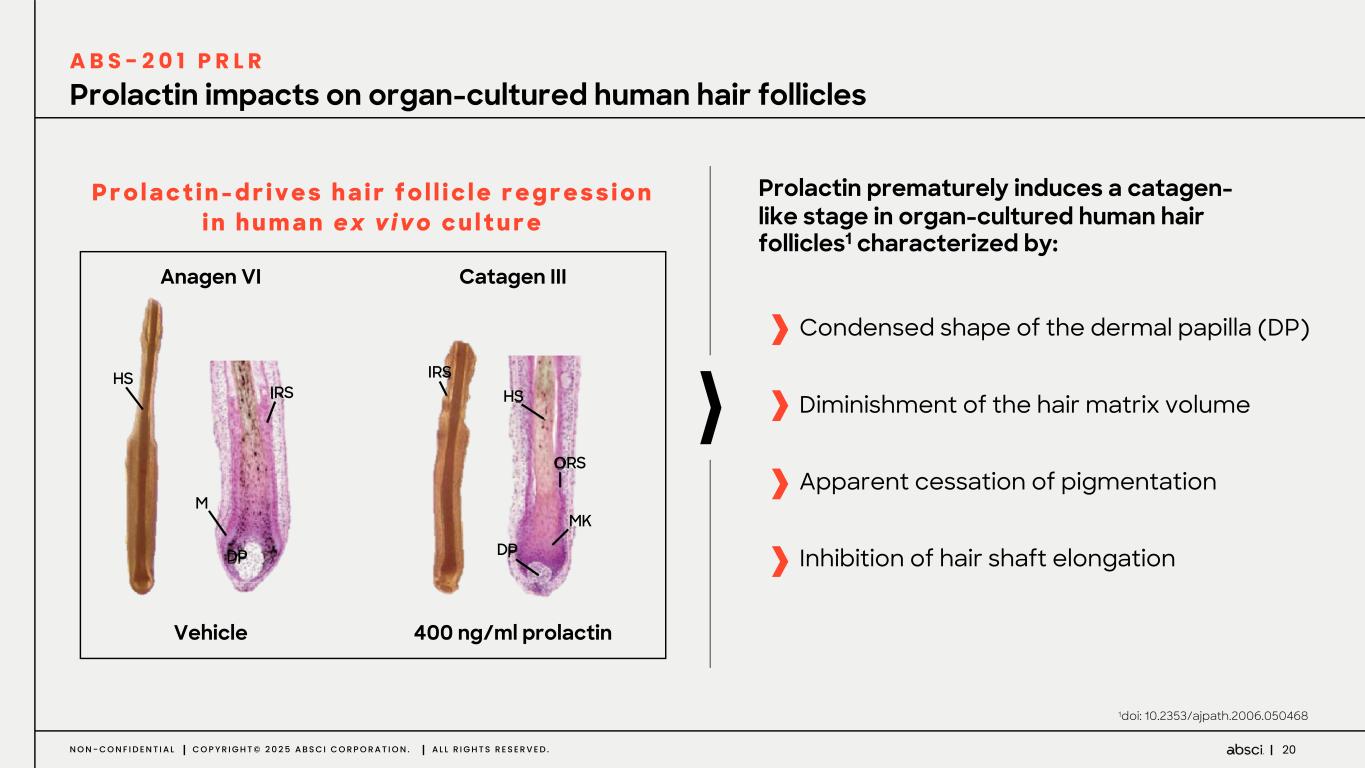
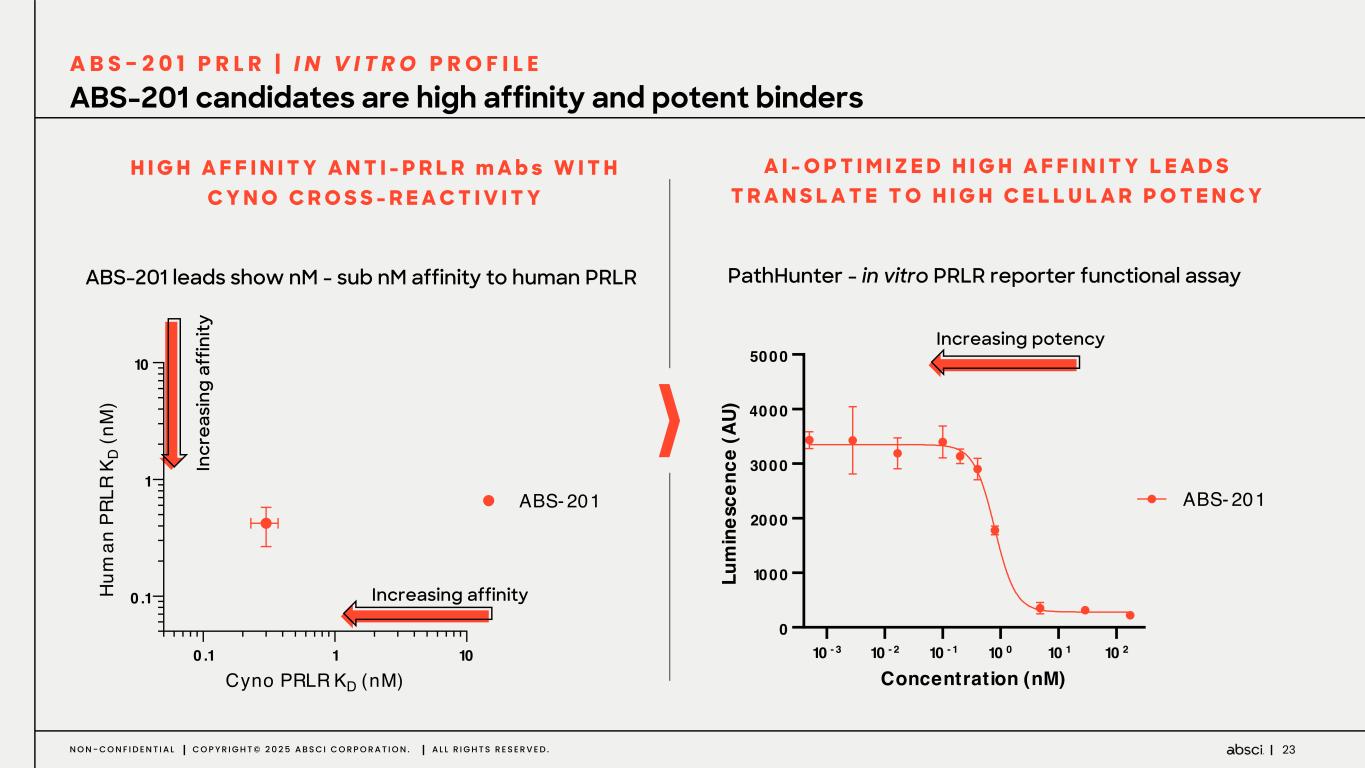
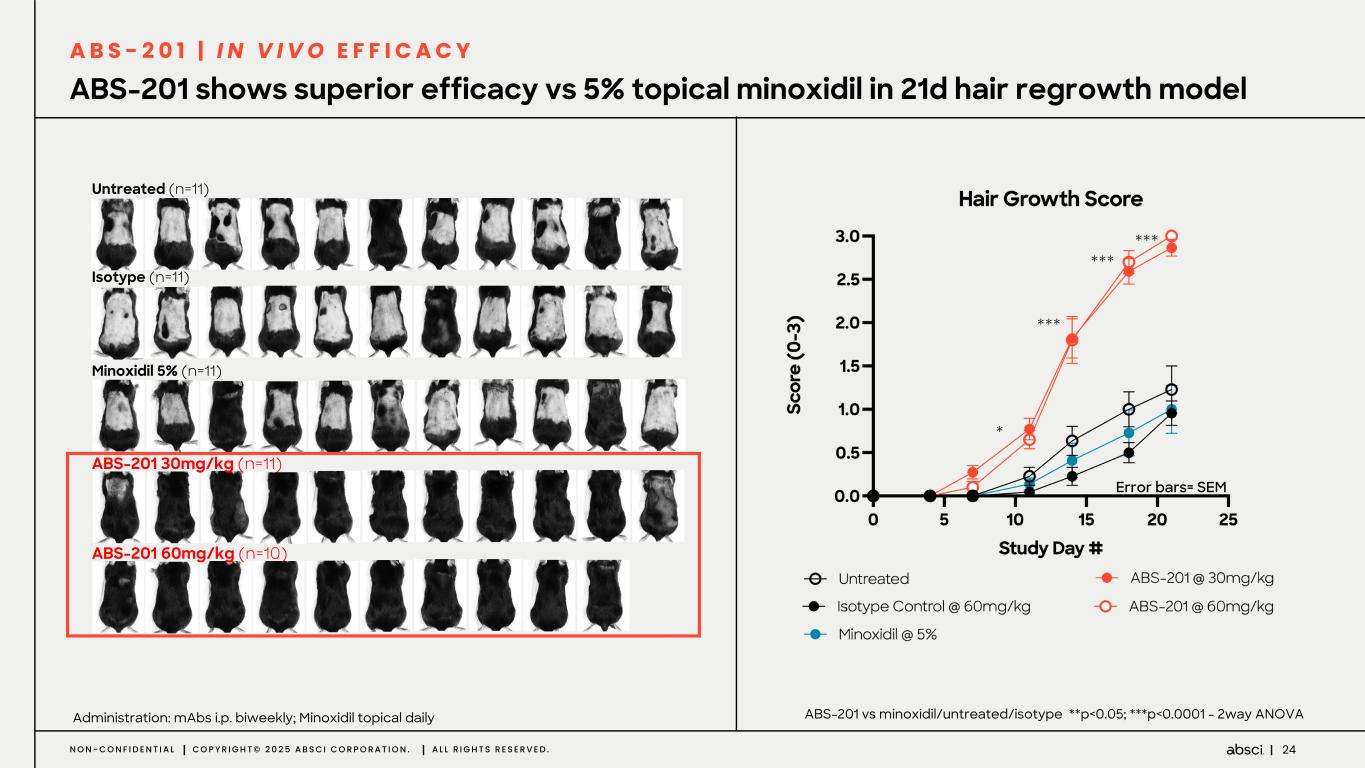
-ABS-201(クラス最高の抗PRLR抗体の可能性):ABS-201は、アンメット・クリニカル・ニーズが高く、米国だけでも約8,000万人の患者が存在する男性型脱毛症を適応症として開発中のクラス最高の抗PRLR抗体候補です。Absci社は、高い親和性と効力、良好な安全性と免疫原性、半減期の延長による投与頻度の低減、優れた開発性と製造性を示唆する前臨床プロファイルを有する開発候補品を指名しました。ABS-201は、ミノキシジルと比較して発毛の改善を示すABS-201の前臨床モデルによって証明されるように、現在の標準治療と比較してより有効で安全な選択肢を提供する可能性があります。また、ABS-201のNHP試験の結果も本日発表し、本プログラムが患者に利便性が高く、持続的で有効な男性型脱毛症の治療選択肢を提供できる可能性をさらに裏付けました。本試験のデータは、半減期が延長され、ヒトでのQ8W-Q12W投与間隔に変換できる可能性を示しています。また、本試験では、NHPにおいて90%以上の高い皮下バイオアベイラビリティが示され、観察された薬物動態プロファイルから、臨床的に適切な用量で標的臓器(特に皮膚と毛包)に大量に曝露されることが予測され、臨床的に意味のある有効性につながると期待される。さらに、ABS-201の製造可能性および開発可能性プロファイルは、将来的に150mg/mLを超える高濃度製剤を可能にする可能性がある。ABS-201は、2026年初頭に臨床第1相試験を開始し、2026年後半に中間的な有効性を確認する予定である。
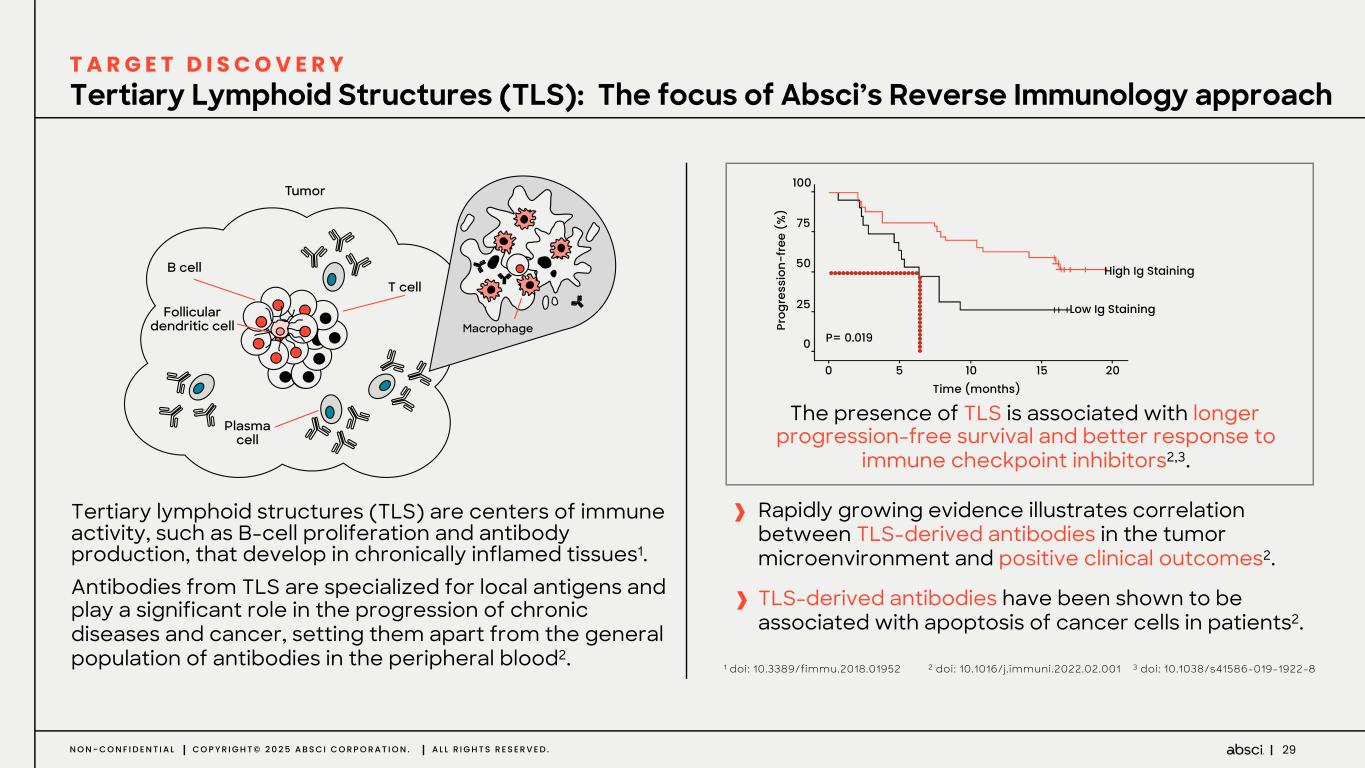
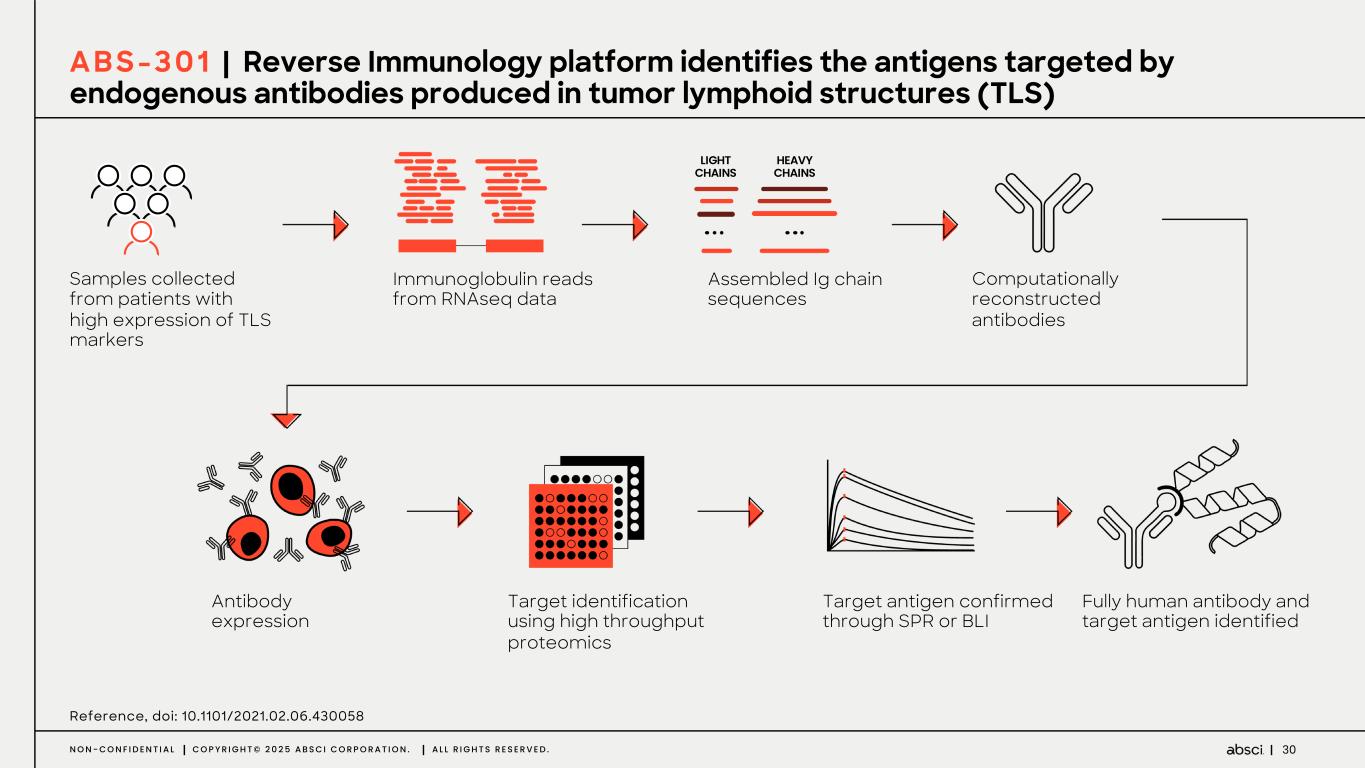
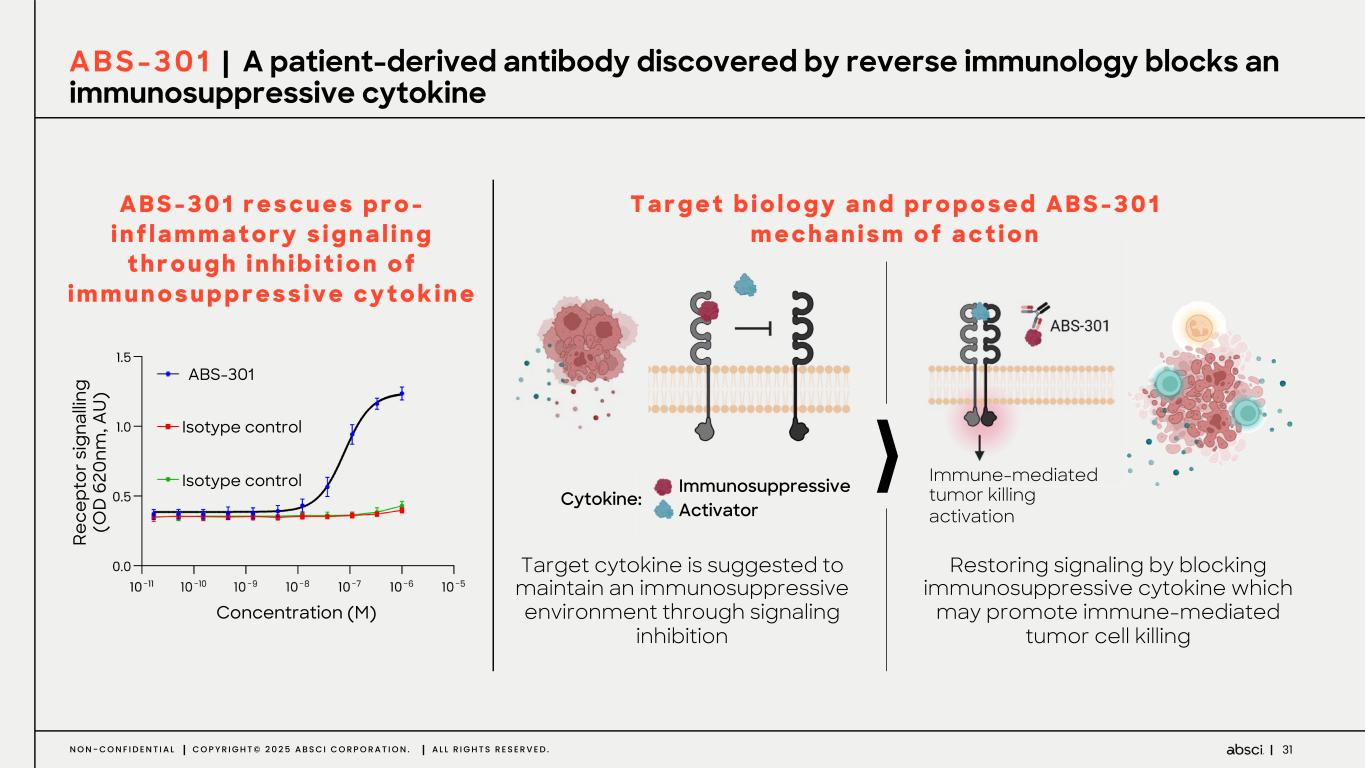
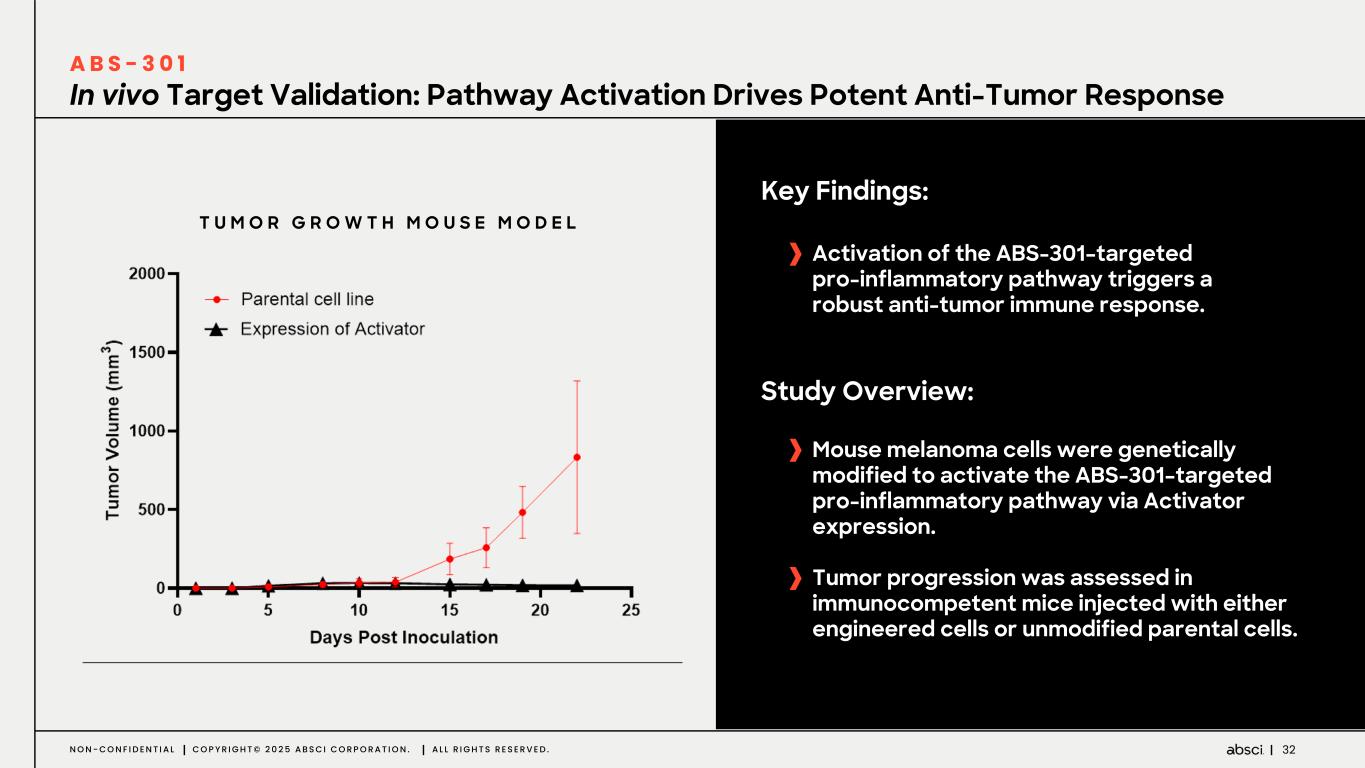
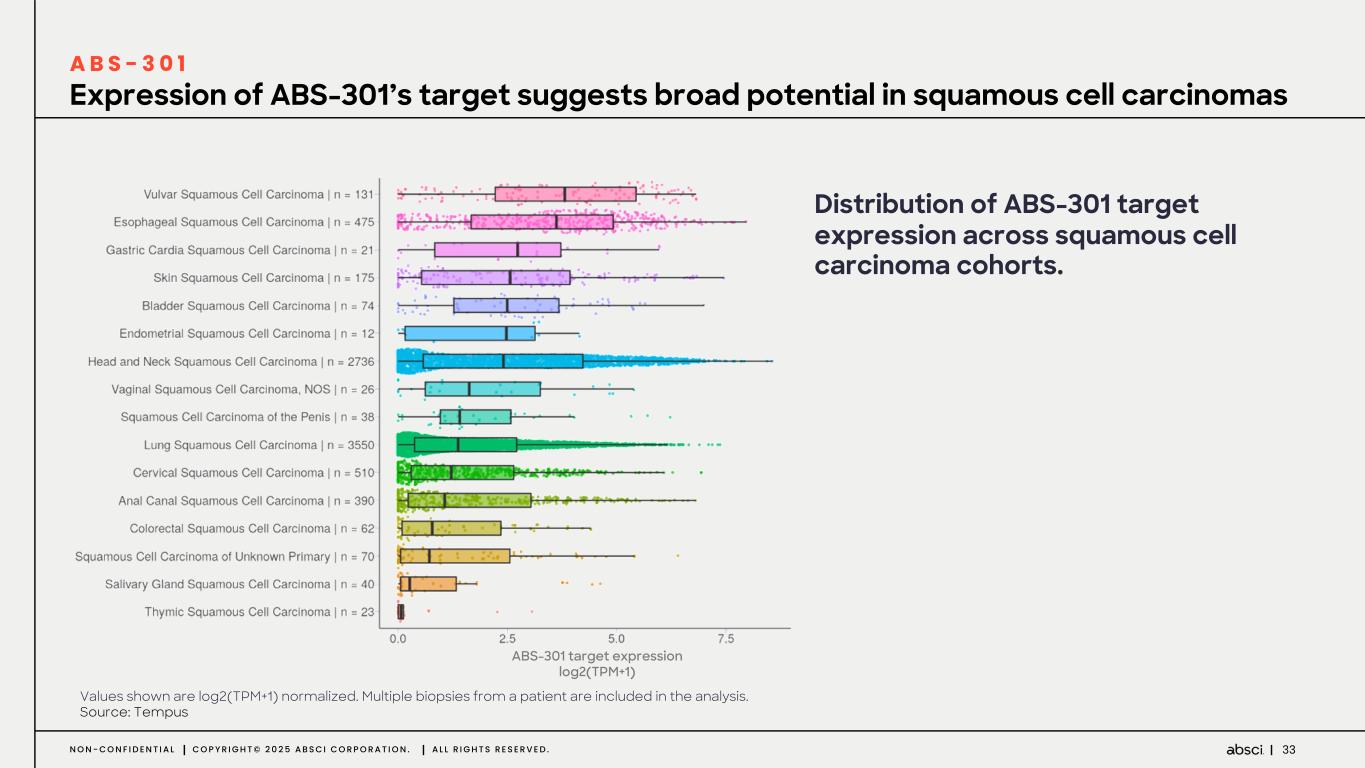
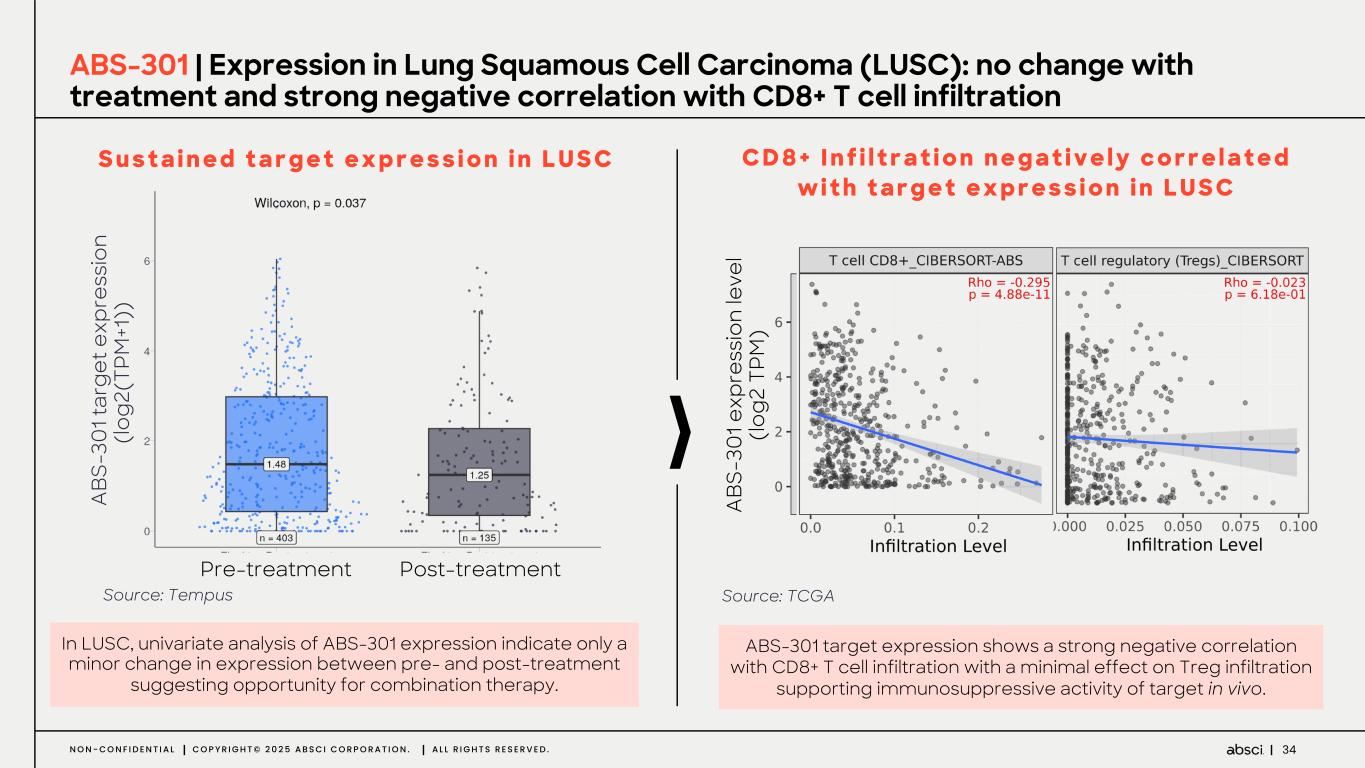
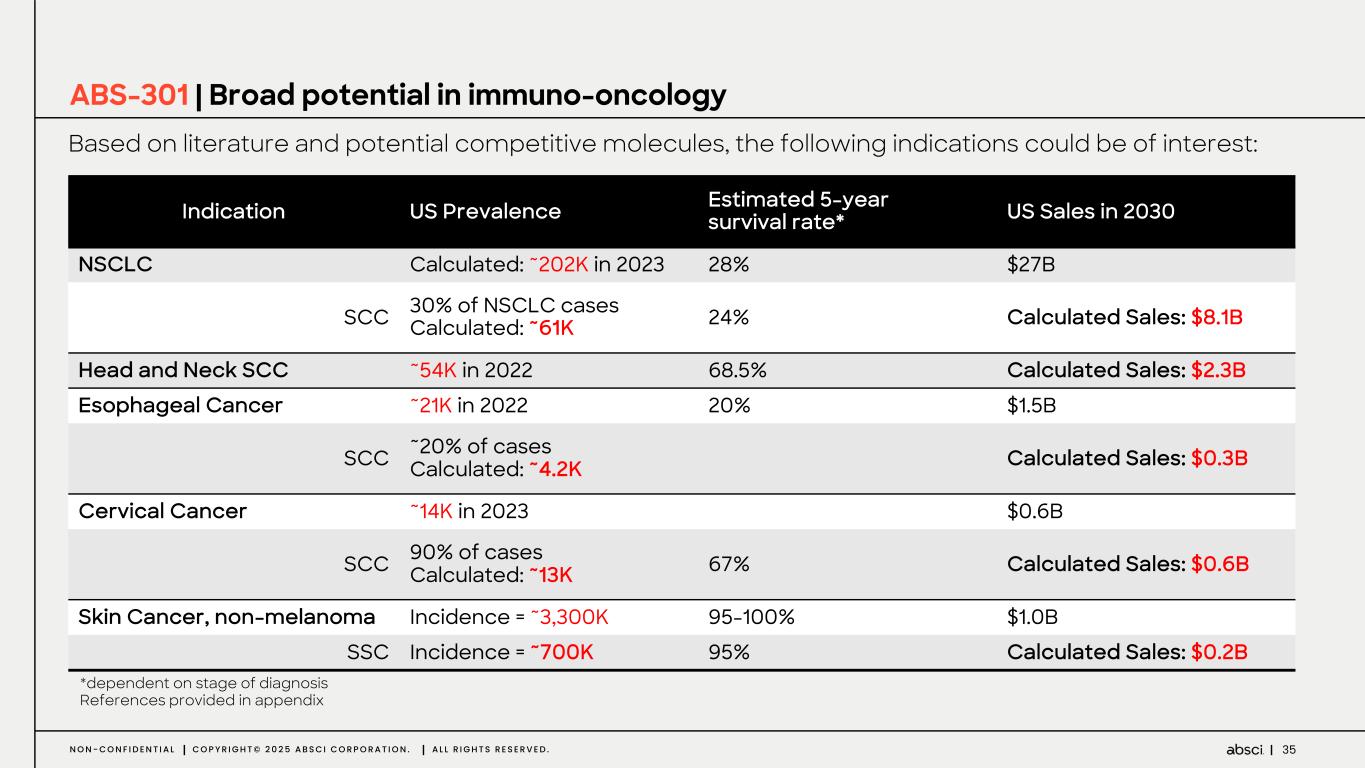
-ABS-301(未発表の免疫腫瘍学的標的に対するファースト・イン・クラス抗体の可能性):ABS-301は、AbsciのReverse Immunologyプラットフォームにより発見された新規ターゲットに結合するようデザインされた完全ヒト抗体である。ABS-301の標的の発現は、扁平上皮癌をはじめとする幅広い可能性を示唆している。このプログラムにおいて、Absciは高い親和性と効力を持つ抗体リードを最適化し、最初のin vivo標的検証試験を成功裏に完了した。この試験で得られた知見から、この経路を介したシグナル伝達が強力な抗腫瘍反応を引き起こすことが示され、ABS-301のin vivo有効性試験を進める強力な根拠となった。
これらの結果は、前臨床試験を継続し、ABS-301の治療の可能性をさらに追求することを支持するものである。
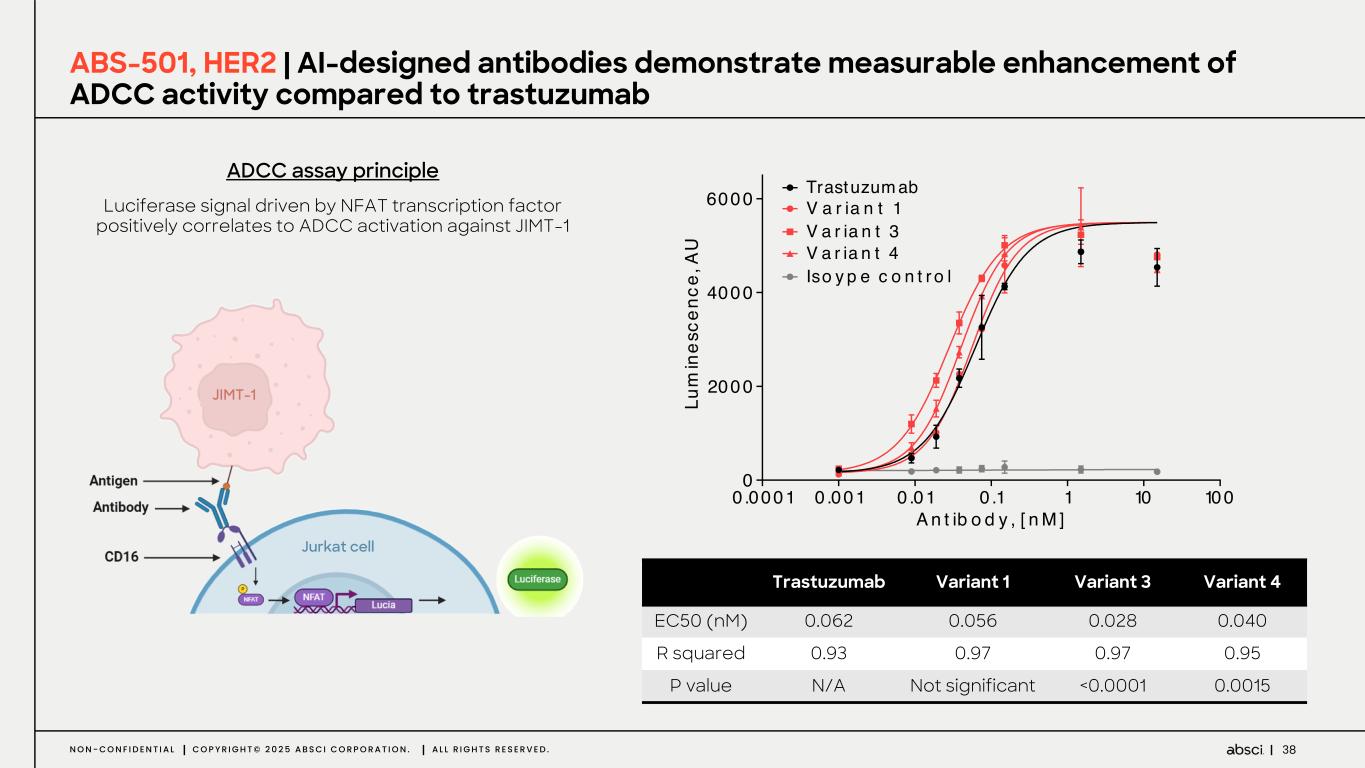
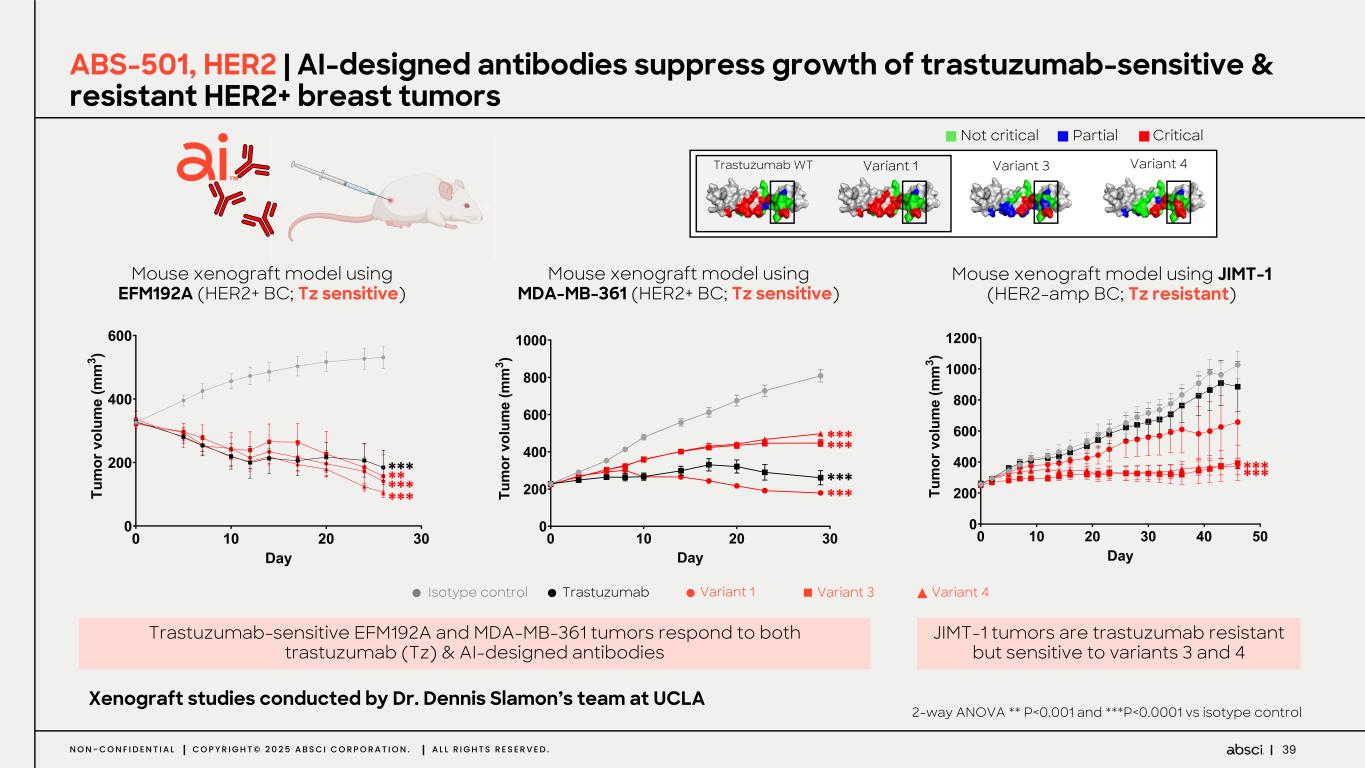
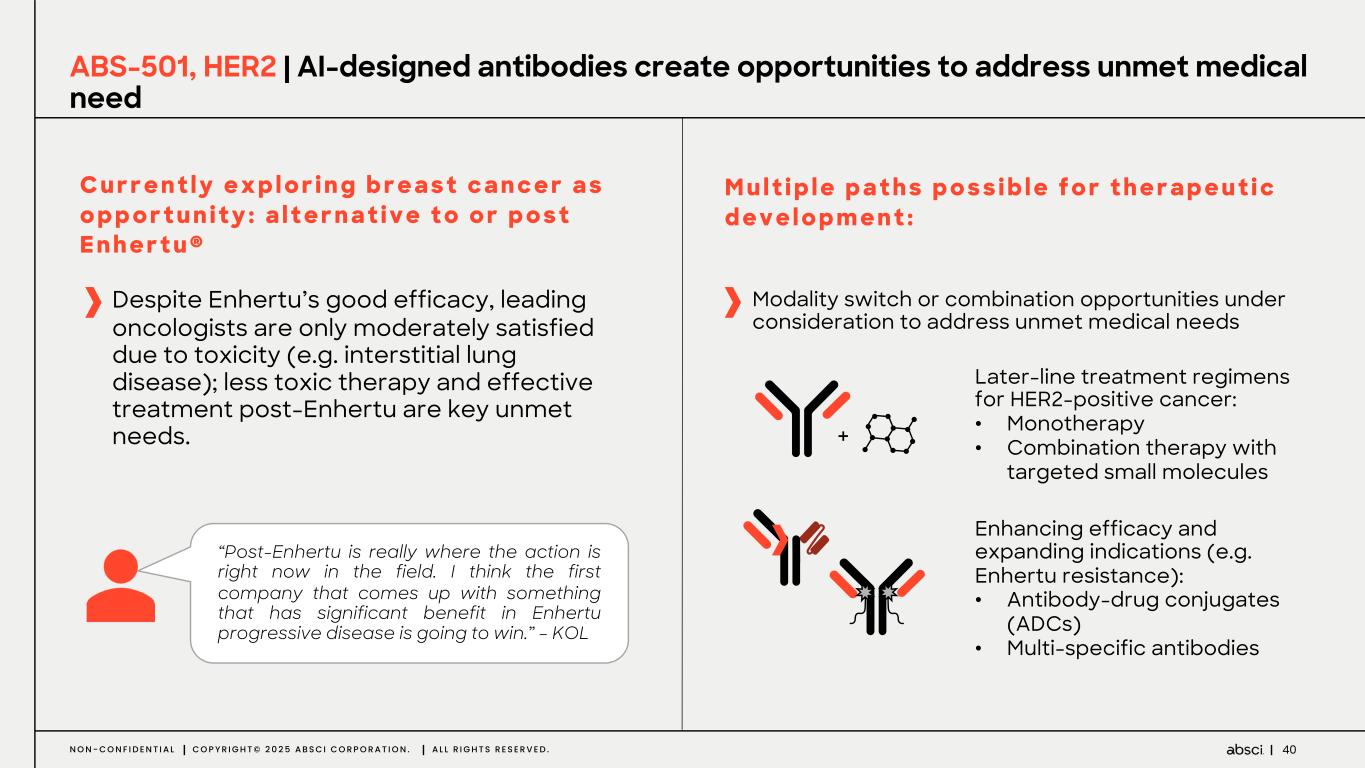
-ABS-501(クラス最高の新規抗 HER2 抗体):このプログラムでは、Absci 社のゼロショット de novo AI 技術を用いて、新規エピトープ相互作用、前臨床におけるトラスツズマブに対する親和性の向上または同等、野生型 HER2 を発現するトラスツズマブ抵抗性異種移植腫瘍に対する有効性、良好な開発可能性といった特徴を有する抗体リードを同定しました。
-創薬パートナーシップ:Absciは既存の創薬パートナーシップをさらに進展させ、2025年には大手製薬会社を含む1つ以上のパートナーシップを締結する予定である。
Absci社は、現在および将来の提携プログラムとともに、社内のパイプラインを推進し、継続的なプラットフォームの改善と業務の効率化を達成するために、投資と業務に引き続き注力していく。Absci社は、現在の計画に基づき、既存の現金、現金同等物、短期投資で2027年前半までの事業資金をまかなうことができると考えている。
2025年第1四半期決算
2025年3月31日に終了した3ヵ月間の収益は120万ドルであったのに対し、2024年3月31日に終了した3ヵ月間は0.9百万ドルであった。
研究開発費は、2024年3月31日に終了した3ヵ月間が1,220万ドルであったのに対し、2025年3月31日に終了した3ヵ月間は1,640万ドルであった。この増加の主な要因は、外部前臨床開発に関連する直接費用を含むアブシ社の社内プログラムの進展、人件費および株式報酬費用の増加である。
販売費および一般管理費は、2024年3月31日に終了した3ヵ月間が870万ドルであったのに対し、2025年3月31日に終了した3ヵ月間は950万ドルであった。この増加は株式報酬費用の増加によるものである。
純損失は、2024年3月31日に終了した3ヵ月間が2,200万ドルであったのに対し、2025年3月31日に終了した3ヵ月間は2,630万ドルであった。
2025年3月31日現在の現金、現金同等物および短期投資は、2024年12月31日現在の1億1,240万ドルに対し、1億3,400万ドルであった。
Webcast Information
アブスキ社は、2025年第1四半期の業績および財務・業績に関する電話会議を、米国東部時間5月13日(火)午後4時30分(太平洋時間5月13日(火)午後1時30分)より開催します。カンファレンス・コールのウェブキャストはinvestors.absci.comでご覧いただけます。ウェブキャストはアーカイブされ、イベント終了後少なくとも90日間は再生可能です。
About Absci
アブシティは、より優れた生物製剤をより早く患者さんのために創製するために、ジェネレーティブ・デザインを用いて創薬の未来を進めています。当社のIntegrated Drug Creation™プラットフォームは、最先端のAIモデルと合成生物学データエンジンを組み合わせ、困難な治療ターゲットに対応する革新的な治療薬の迅速な設計を可能にします。Absciのアプローチは、高度なAIアルゴリズムとウェットラボでの検証の間の継続的なフィードバックループを活用しています。サイクルを繰り返すごとにデータが洗練され、モデルが強化されるため、迅速なイノベーションが促進され、治療デザインの精度が向上します。製薬、バイオテクノロジー、ハイテク、アカデミックのトップ企業との提携と並行して、AbsciはAIが設計した治療薬の自社パイプラインを進めている。その中には、炎症性腸疾患(IBD)やその他の適応症を治療するクラス最高の抗体となりうるABS-101や、男性型脱毛症や女性型脱毛症として知られる男性型脱毛症の治療の可能性を再定義する可能性を秘めた、発毛における画期的なイノベーションであるABS-201が含まれる。ABSCI社は、ワシントン州バンクーバーに本社を置き、ニューヨークにAI研究所、スイスにイノベーションセンターを構えています。詳細はwww.absci.com、LinkedIn(@absci)、X(@Abscibio)、YouTubeでフォローしてください。
Forward-Looking Statements
本プレスリリースに記載されている記述のうち、歴史的事実でないものは、1995年私募証券訴訟改革法、1933年証券法改正法第27条A、および1934年証券取引法改正法第21条Eで定義される意味において、将来の見通しに関する記述とみなされます。これには、「予定する」、「追求する」、「予想する」、「計画する」、「考える」、「予測する」、「可能性」、「目標」、「推定する」、「拡張する」、「期待する」、「意図する」、またはこれらに類似する表現が含まれます。当社は、事業運営、ポートフォリオ戦略、財務実績、業績に関する当社の期待、提携の成功に関する当社の期待とガイダンス、ガイダンスの改訂を含む現金、現金同等物、短期投資の総使用額、予測される現金の使用量、ニーズ、資金調達方法、追加提携先との契約とその数、提携に含まれるプログラムの数に関する当社の期待など、これらの将来見通しに関する記述を意図しています、当社の技術開発努力とその応用(当社のプラットフォームの一般化、医薬品開発期間の短縮、コスト削減による創薬の経済性の改善、医薬品開発の成功確率の向上を含む)、差別化された抗体治療薬候補を効率的な方法で創出するためにパートナーと協力して実行する能力、現在または将来のパートナーとそのような候補に関連する開発・商業化戦略を構築し、成功させる能力、また、アンメットニーズのある疾患を治療するための差別化された治療薬を設計・開発する当社の能力、当社のプラットフォーム技術を潜在的なパートナーに販売する当社の能力、臨床開発戦略、リードステージへの昇格、前臨床試験の完了、候補化合物の選択、IND取得可能試験、臨床試験の開始を含む様々な開発段階の進捗とタイミング、これらのプログラムに関連するデータの作成と開示を含む当社の内部資産プログラム、前臨床試験結果およびデータの製品候補への変換、ならびに競合分子との比較や差別化された臨床効果または製品プロファイルにつながることを含む前臨床試験結果の意義は、証券法第27条Aおよび証券取引法第21条Eに含まれる将来予想に関する記述のセーフハーバー条項の対象となるものであり、当社はこれらのセーフハーバー条項を遵守する目的で本声明を行うものです。
これらの将来見通しに関する記述は、当社の計画、意図、期待、戦略、見通しに関する現在の見解を反映したものであり、現在入手可能な情報および当社が行った仮定に基づいています。さらに、実際の結果は、将来見通しに関する記述に記載されたものとは大きく異なる可能性があり、FDAやその他の規制当局から必要な承認を取得・維持すること、前臨床試験で観察された有望なまたは肯定的な結果を臨床試験で再現すること、社内の資産プログラムをサポートするために第三者に依存することなどに関連するリスクや不確実性を含むがこれらに限定されない、当社が制御できないさまざまなリスクや要因の影響を受けます、当社の製品候補またはそのコンポーネントの前臨床および臨床供給品の製造および供給を含む、当社の内部資産プログラムをサポートする第三者への依存、当社のパートナーまたはパートナー候補との研究、創薬および開発活動における効果的な協力能力、当社のパートナーシップ契約の条項に基づいてプログラムまたは製品候補の開発および商業化を追求する当社の既存および潜在的パートナーの能力および意欲、当社およびパートナーのこれらの契約に基づく活動に影響を与える可能性のある全般的な市場状況および規制の動向、ならびに米国証券取引委員会に提出された最新の定期報告書に記載されたリスク。また、当社が米国証券取引委員会に提出した最新の定期報告書に記載されているリスクや、その後の米国証券取引委員会への提出書類における潜在的なリスク、不確実性、およびその他の重要な要因に関する議論も参照してください。法律で義務付けられている場合を除き、当社は、新たな情報、将来の出来事、その他の結果にかかわらず、いかなる将来見通しに関する記述も公に更新する義務を負いません。
Investor Contact:
Alex Khan
財務・IR担当副社長
investors@absci.com
Media Contact:
press@absci.com
absci@methodcommunications.com
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべ
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めて














 株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン
株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン