Document
ニューロジーン社、2025年第2四半期決算と最近のハイライトを発表
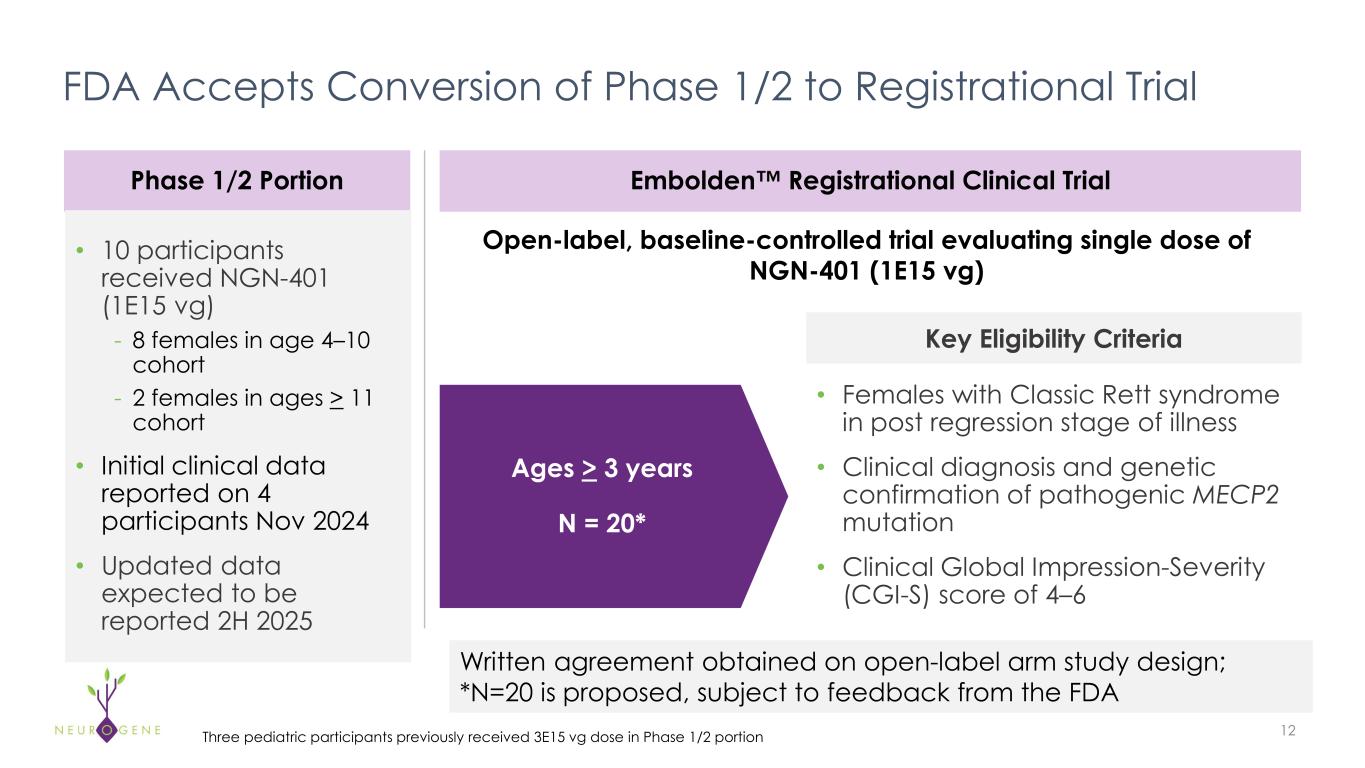
レット症候群を対象としたNGN-401遺伝子治療薬Embolden™の登録臨床試験デザインを発表、試験開始に向けて活動中
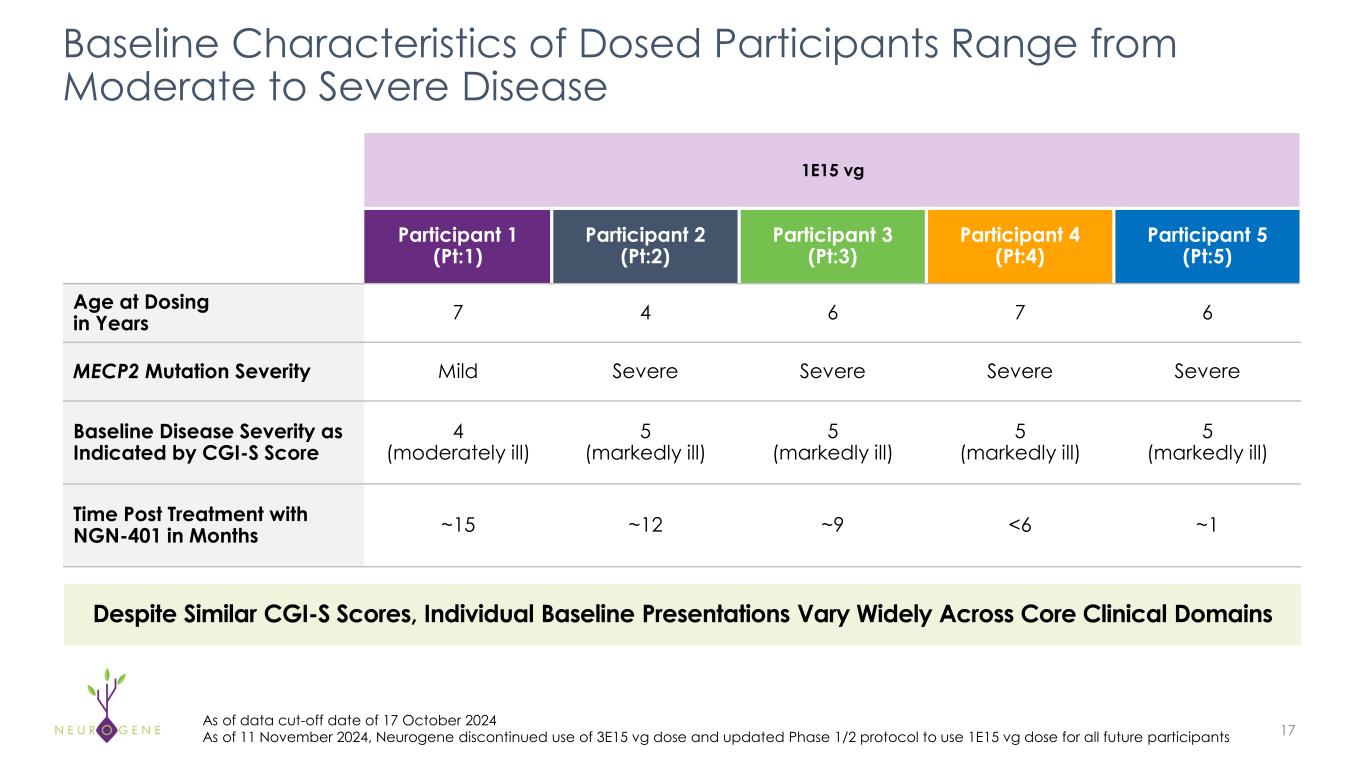
第1/2相NGN-401試験の投与を完了し、2025年後半に最新の臨床有効性と安全性データを報告する予定である。
2028年初頭までのキャッシュ・ランウェイ
ニューヨーク-2025年8月11日-希少な神経疾患に苦しむ患者やその家族に、人生を変える遺伝子医薬品を提供するために設立された臨床段階の企業であるニューロジーン・インク(Nasdaq: NGNE)は本日、2025年第2四半期の業績を発表し、最近の企業の最新情報を強調しました。
「2025年上半期、私たちはレット症候群を対象としたNGN-401プログラムで大きな進展を遂げました。ニューロジーン社の創業者であり最高経営責任者であるレイチェル・マクミン博士は、次のように述べています。「私たちは、第1/2相臨床試験の最後の5人の被験者への投与を完了し、すでに開始活動を開始しているエンボルデン™登録試験の主要な要素について、米国FDAから書面による合意を得ました。「エンボルデンは、KOL、介護者、支払者が臨床的に意義があると考える指標を組み込んだ主要評価項目で、3歳の参加者を評価することにより、NGN-401を差別化するために意図的かつ厳密にデザインされたものです。先に発表した資本の再配分により、2028年初頭まで資金を確保することができ、新たな治療選択肢を緊急に必要としている患者さんとご家族のために、この可能性のある治療法の進展に経営資源を集中することができます」。
FDAは、STARTプログラムでの継続的な対話を活用し、エンボルデンの主要評価項目を12ヶ月にとどめ、完全承認の根拠とするよう促しました。Embolden試験の厳密なデザインをさらに維持するために、我々はEmbolden登録試験の一部として、第1/2相試験から予定されていた最後の参加者を投与することを選択し、さらに1名の参加者を追加して、予定サンプル数を20名とします。"
2025年第2四半期と最近のハイライト、そして予想されるマイルストーン
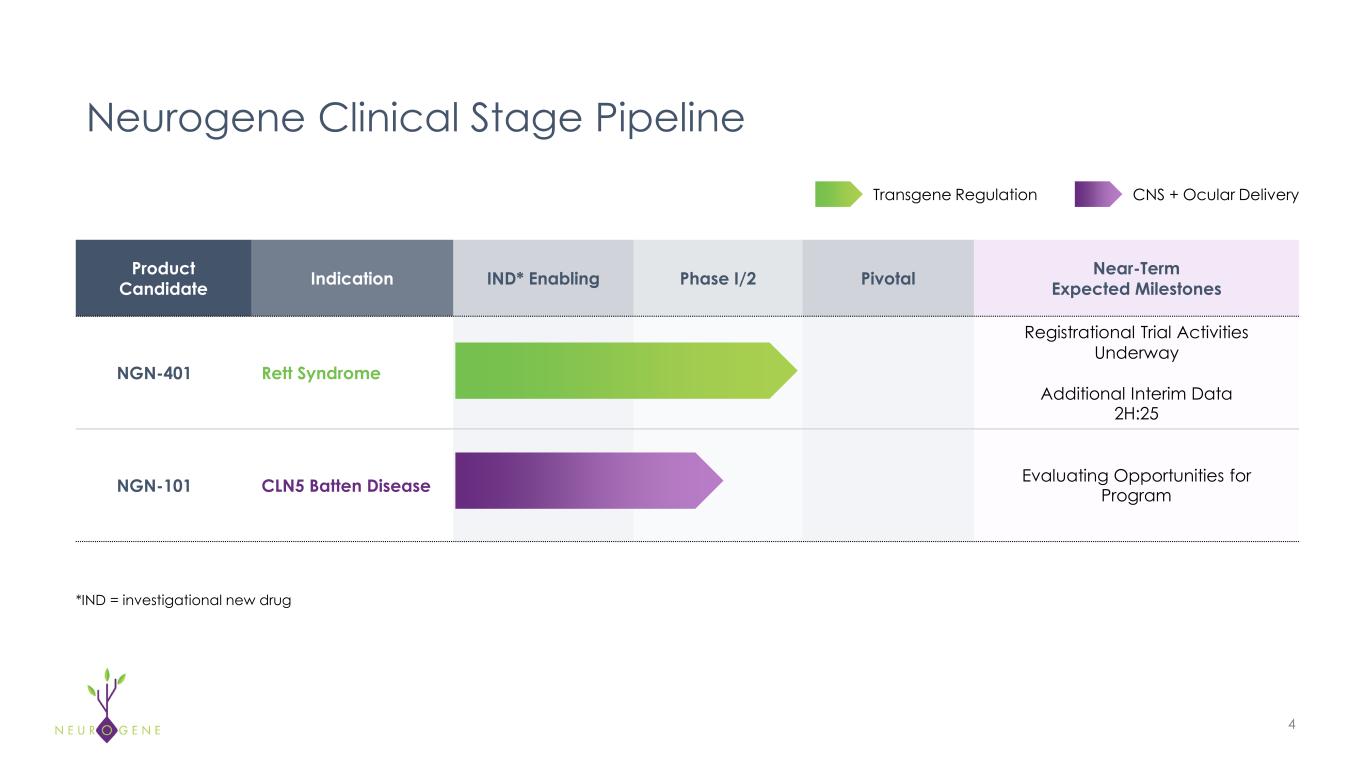
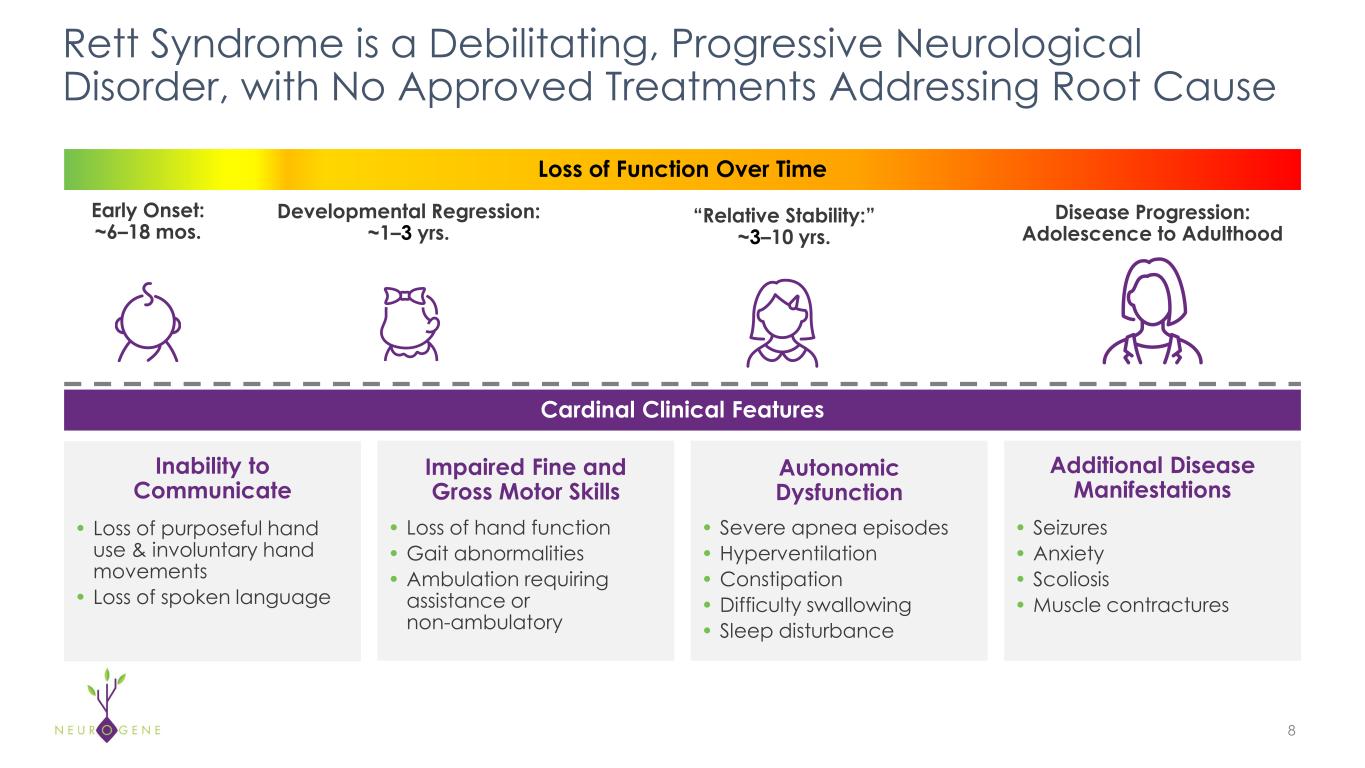
NGN-401遺伝子治療によるレット症候群の治療
-米国食品医薬品局(FDA)よりNGN-401のEmbolden登録試験の主要な要素について同意書を受領。
-第1/2相臨床試験から登録試験への移行を支援するため、エンボルデンの臨床試験活動を開始。
-フェーズ1/2試験の登録が完了し、2025年前半に最後の5人が追加投与された。
-2025年後半に第1/2相臨床試験の有効性と安全性の最新データを報告する予定である。
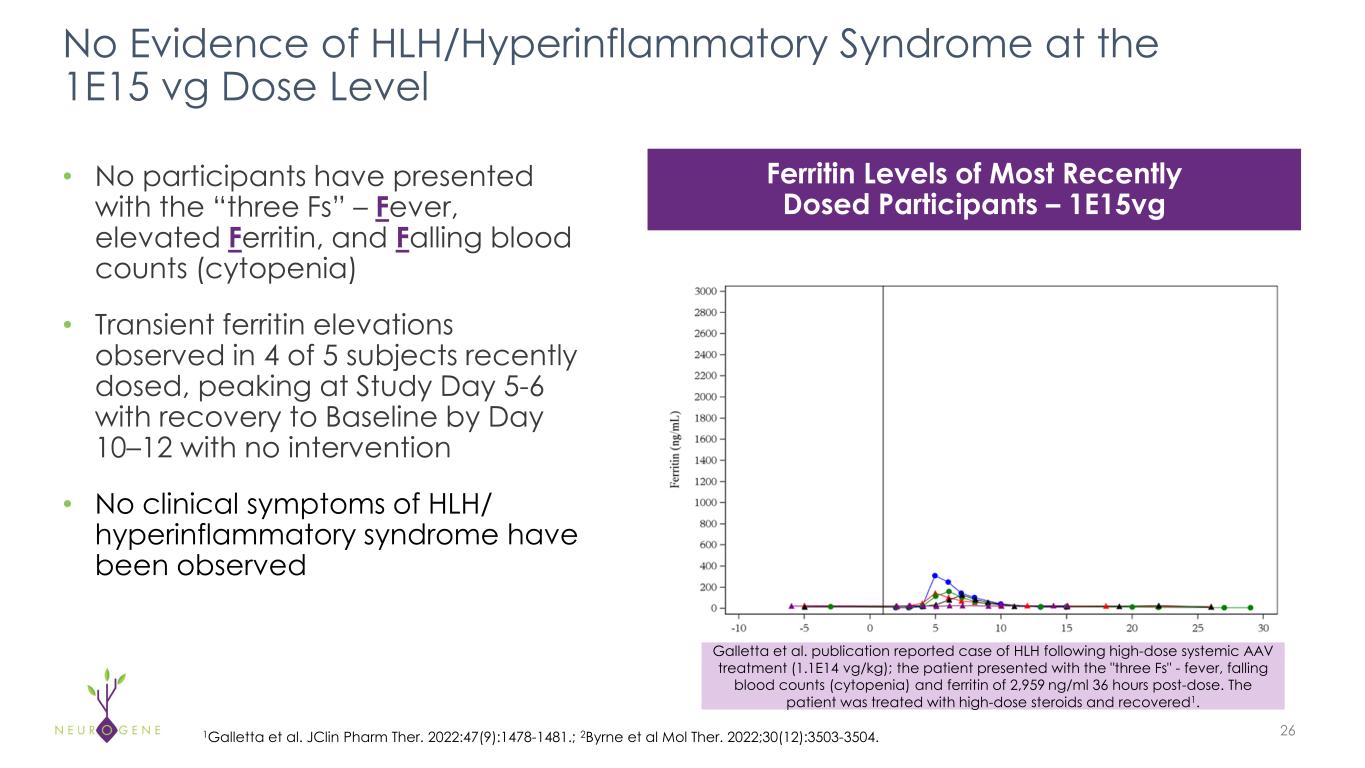
-NGN-401臨床試験に組み込まれた血球貪食性リンパ組織球症(HLH)のモニタリングと治療のアルゴリズムを学会で発表。
o本プレスリリースの発表日現在、NGN-401試験参加者において、1E15 vg用量レベルでのHLH/炎症性症候群のエビデンスはありません。
Upcoming Events
-スティフェル・バイオテック・サマー・サミット:経営陣は8月12日午後12時(米国東部時間)よりファイヤーサイドチャットに参加します(ウェブキャストではありません)。
-H.C.ウェインライト年次グローバル投資会議:経営陣は9月8日午後2時30分(米国東部時間)からのファイヤーサイドチャットおよび1x1ミーティングに参加する。
2025年第2四半期決算
-現金、現金同等物および短期投資:現金、現金同等物および短期投資:2025年6月30日現在の現金、現金同等物および短期投資は2億7,450万ドルであった。現在のところ、現金、現金同等物および短期投資は、2028年初頭までの計画的な事業運営に必要な資金を賄うことができると見込んでいる。
-研究開発費:研究開発費は、2024年6月30日に終了した3カ月間の1,570万ドルに対し、2025年6月30日に終了した3カ月間は1,940万ドルであった。2025年6月30日に終了した3ヵ月間における研究開発費の増加は、主にレット症候群の臨床試験費用の増加および研究開発人員の増加に伴う従業員関連費用の増加によるものです。
-一般管理費:2025年6月30日に終了した3ヵ月間のG&A費は670万ドルで、2024年6月30日に終了した3ヵ月間は530万ドルであった。2025年6月30日に終了した3ヵ月間のG&A費の増加は、主に株式報酬、従業員数、その他会社経費の増加による従業員関連費用の増加によるものである。
-純損失:2025年6月30日に終了した3ヵ月間の純損失は2,200万ドル(2024年6月30日に終了した3ヵ月間は1,850万ドル)。
About Neurogene
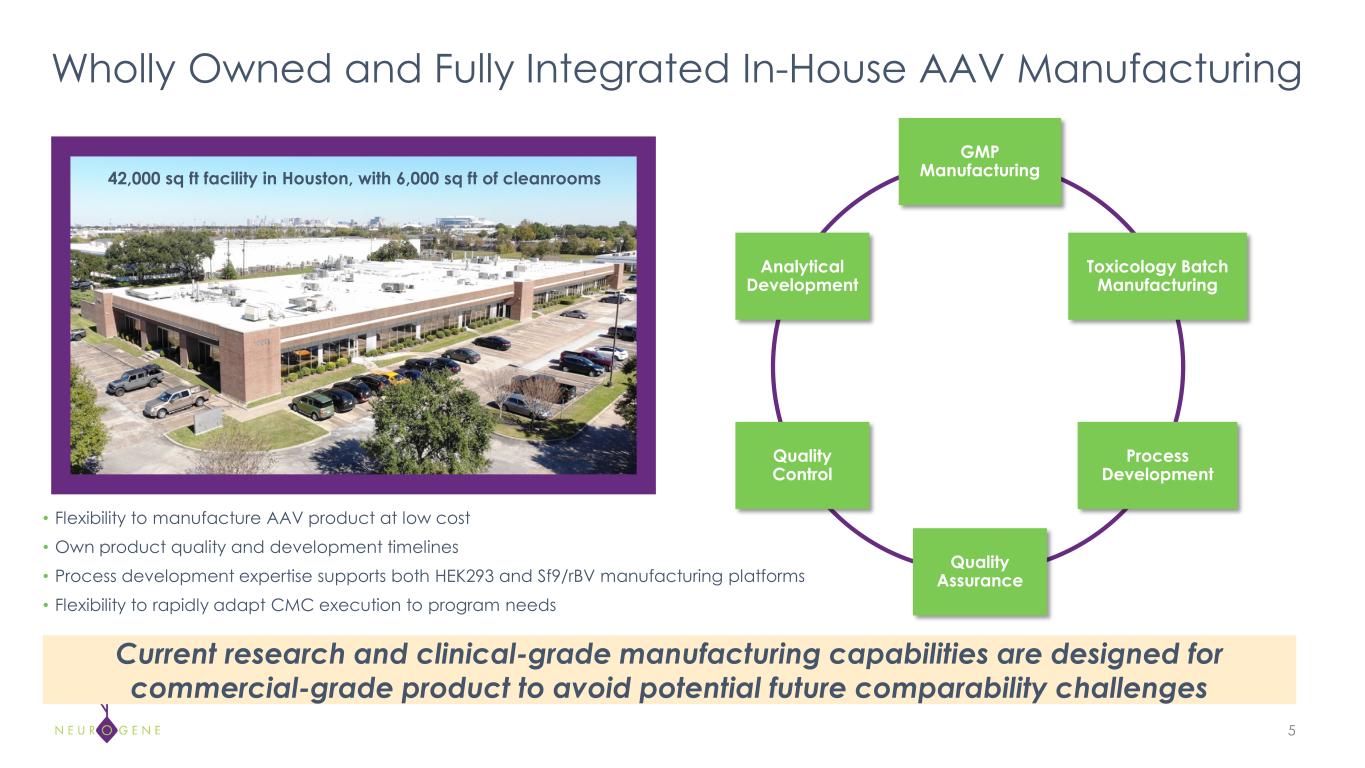
ニューロジーン社の使命は、壊滅的な神経疾患を治療し、これらの希少疾患の影響を受けている患者と家族の生活を改善することである。ニューロジーン社は、中枢神経系疾患における従来の遺伝子治療の限界に対処するため、新しいアプローチと治療法を開発している。これには、標的組織への分布を最大化するデリバリー・アプローチの選択や、有効性と安全性のプロファイルを最適化するために効力と純度を最大化する製品設計が含まれる。ニューロジーン社が独自に開発した新規のEXACT™導入遺伝子制御プラットフォーム技術により、従来の遺伝子治療に伴う導入遺伝子の毒性を抑えながら、治療レベルの導入が可能となる。ニューロジーンはテキサス州ヒューストンに最先端の遺伝子治療製造施設を建設した。NGN-401のCGMP製造はこの施設で行われ、極めて重要な臨床開発活動をサポートする。詳細はwww.neurogene.com。
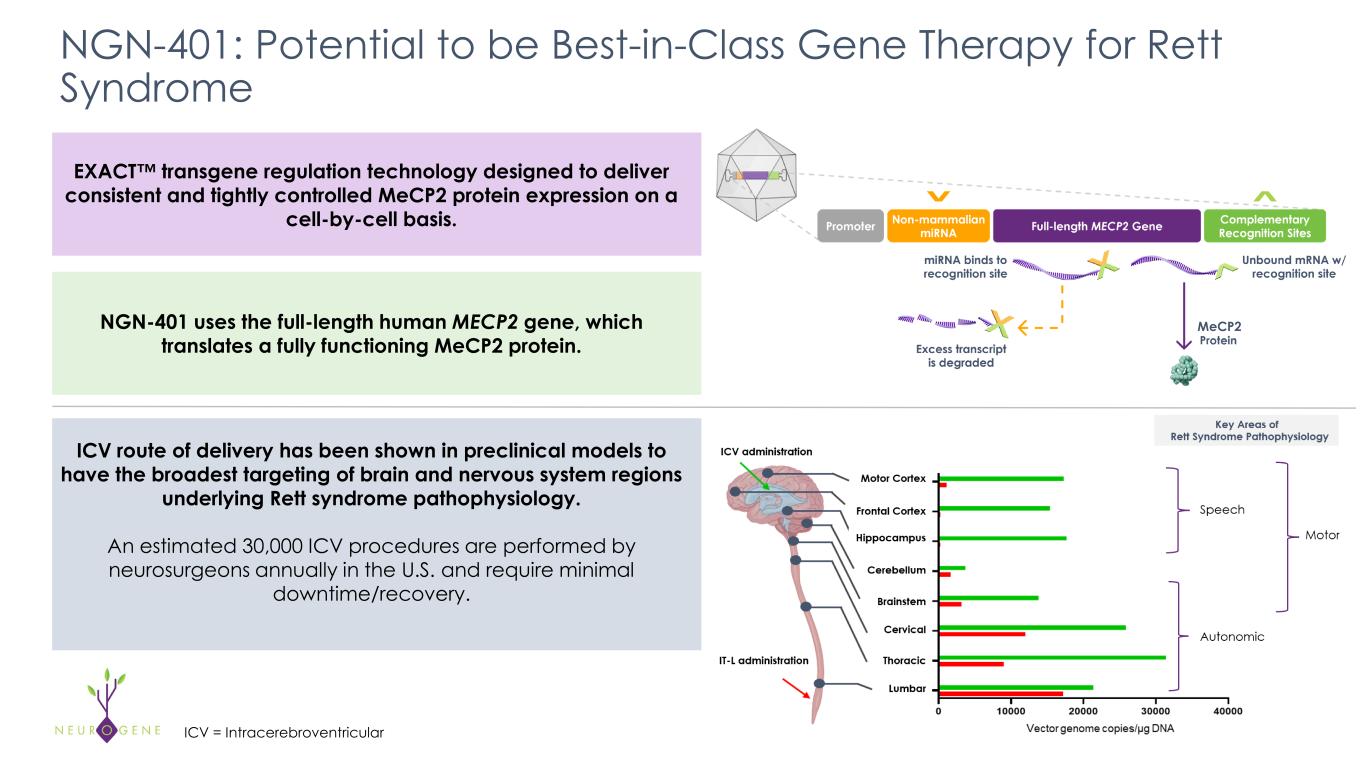
About NGN-401
NGN-401は、レット症候群の1回限りの治療薬として開発中の治験用AAV9遺伝子治療薬である。NGN-401は、ニューロジーン社のEXACT™遺伝子導入制御技術により、完全長ヒトMECP2遺伝子を導入した最初の臨床候補薬です。EXACT技術はレット症候群の遺伝子治療において重要な進歩であり、特にこの疾患では、従来の遺伝子治療に見られる過剰発現に関連した毒性作用を引き起こすことなく、標的レベルのMECP2導入遺伝子の発現を可能にする治療アプローチが必要とされているからである。
NGN-401は、米国食品医薬品局(FDA)のSTART試験プログラムに採用され、また、FDAから再生医療促進療法(RMAT)指定、希少疾病用医薬品指定、ファスト・トラック指定、希少小児指定を受けている。ニューロジーン社は、EXACT技術に関してFDAとのINTERACTミーティングを以前に許可されている。NGN-401はまた、欧州医薬品庁(EMA)から優先医薬品(PRIME)指定、希少疾病用医薬品指定、先進治療薬指定を受け、英国医薬品医療製品規制庁(MHRA)から革新的ライセンス・申請経路(ILAP)指定を受けています。ニューロジーンは、適用される米国証券法に基づき要求される場合を除き、本プレスリリースの日付後に発生する事象や状況を反映するために、これらの記述を更新する義務を負うものではありません。
本プレスリリース中の記述のうち、歴史的事実でないものは、1995年米国私募証券訴訟改革法(Private Securities Litigation Reform Act of 1995)に定義される「将来予想に関する記述(forward-looking statements)」であることを意図しており、ここに明記します。これらの記述は、ニューロジーン社の経営陣の現在の期待および確信、ならびにニューロジーン社の経営陣による仮定および現在入手可能な情報に基づく、将来の計画、動向、出来事、経営成績、財務状態などに関する目標、意図、期待について述べたものであり、以下の記述を含みますが、これらに限定されるものではありません:NGN-401の治療可能性、有用性、有効性、臨床的利益、NGN-401の試験デザイン、臨床開発計画、および時期(エンボルデン試験の参加者数案、NGN-401の第1/2相臨床試験から登録臨床試験への移行時期など、FDAの最終承認を条件とする登録臨床試験デザインの要素を含む)、レット症候群を対象とするNGN-401のエンボルデン登録試験の追加更新の予想時期;当社のレット症候群を対象としたNGN-401フェーズ1/2試験からの中間データの追加予想時期、FDAとの予想される将来的な相互作用またはFDAの見解、および既存の現金資源が当社の運営資金として十分である可能性のある期間。一般に、将来の見通しに関する記述には、本質的に予測的であり、将来の出来事や状況に依存または言及する記述が含まれ、「かもしれない」、「予定である」、「はずである」、「だろう」、「期待する」、「予想する」、「計画する」、「可能性が高い」、「信じる」、「推定する」、「プロジェクトする」、「意図する」、「予定通り」などの言葉や、これらの言葉の否定形または複数形、あるいは予測である、または将来の出来事や見通しを示す他の類似の表現が含まれますが、すべての将来の見通しに関する記述にこれらの言葉が含まれるわけではありません。将来予想に関する記述は、現時点での判断や仮定に基づくものであり、発生の時期、程度、可能性、程度に関して予測することが困難なリスク、不確実性、仮定に左右されるため、実際の結果が予想と大きく異なる可能性があり、その多くはニューロジーンが制御できないものです。このようなリスク、不確実性および仮定には、特に以下のものが含まれます:NGN-401臨床試験からの追加結果が予想される時期、レット症候群の治療を目的としたNGN-401の第1/2相臨床試験の参加者に悪影響を及ぼす可能性、当社が予測されたスケジュールでデータを報告できない可能性があるリスク、NGN-401を含む当社の製品候補について規制当局の承認を取得し、最終的に商業化する当社の能力に関するリスク;レット症候群を対象としたNGN-401のエンボルデン試験の開始時期に関するリスク、および2025年8月11日に米国証券取引委員会(SEC)に提出されたニューロジーン社の2025年6月30日に終了した四半期に関するフォーム10-Q四半期報告書、および当社がSECに提出した、または今後提出する可能性のあるその他の報告書に含まれる「リスク要因」の見出しで特定されるその他のリスクおよび不確実性。
本コミュニケーションのいかなる内容も、本コミュニケーションに記載された将来の見通しに関する記述が達成されること、またはそのような将来の見通しに関する記述の予定された結果が達成されることを、いかなる人物も表明するものとみなされるべきではありません。本コミュニケーションにおける将来の見通しに関する記述は、それらが作成された時点のものであり、本コミュニケーションにおける注意書きを参照することにより、その全体が限定されます。適用される法律で義務付けられている場合を除き、ニューロジーンは、新たな情報、将来の出来事、またはその他の結果にかかわらず、いかなる将来予想に関する記述も修正または更新する義務、またはその他の将来予想に関する記述を行う義務を負いません。
本コミュニケーションには、参照によって本コミュニケーションに組み込まれるとはみなされない情報へのハイパーリンクが含まれています。
- 財務表は以下の通りです。
ニューロジーン社要約連結貸借対照表データ(単位:千米ドル)
ニューロジーン社要約連結損益計算書(単位:千米ドル、株式情報除く)
会社連絡先:Cara MayfieldVice President, Corporate Affairscara.mayfield@neurogene.com
投資家連絡先:Melissa ForstArgot PartnersNeurogene@argotpartners.com






















 株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン
株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン