米国証券取引委員会
Washington, D.C. 20549
FORM 8-K
1934年証券取引所法第13条または第15条(d)に基づく最新報告書
報告日(最も古いイベントの報告日):2025年8月7日
IMMUNIC社
(チャーターで指定された登録者の正確な名前)
| デラウェア | 001-36201 | 56-2358443 |
| (法人設立の州またはその他の管轄区域) | (Commission File Number) | (IRS Employer Identification No.) |
1200アベニュー・オブ・ジ・アメリカズ、スイート200
New York, NY 10036
USA
(主要経営陣の住所)
登録者の電話番号(市外局番を含む(332) 255-9818
Form8-Kの提出が、以下の条項のいずれかに基づく登録者の提出義務を同時に満たすことを意図している場合は、以下の該当するチェックボックスをチェックしてください:
| ☐ | 証券法に基づく規則425に従った書面によるコミュニケーション(17 cfr 230.425) |
| ☐ | 取引所法の下でのルール14a-12(17 cfr 240.14a-12)に基づく資料の勧誘。) |
| ☐ | 取引所法の規則14d-2(b)に基づく開始前のコミュニケーション(17 cfr 240.14d-2(b)) |
| ☐ | 証券取引法の規則13e-4(c)に基づく開始前のコミュニケーション(17 cfr 240.13e-4(c)) |
法第12条(b)に従って登録された証券:
| Title of each class | Trading Symbol(s) | 登録されている取引所の名称 |
| 普通株式、額面0.0001ドル | IMUX | the nasdaq stock market llc |
登録者が1933年証券法規則405(本章§230.405)または1934年証券取引法規則12b-2(本章§240.12b2)で定義される新興成長企業であるかどうかをチェックマークで示す。
Emerging growth company ☐
新興成長企業の場合、登録者が、取引所法第13条(a)に従って提供される新規または改訂された財務会計基準に準拠するための移行期間の延長を使用しないことを選択した場合は、チェックマークで示す。はい ☐ いいえ
Item 2.02. 営業成績および財務状況
2025年8月7日、Immunic, Inc.は、2025年6月30日に終了した四半期決算を発表し、企業最新情報を提供するプレスリリース(その写しを添付資料99.1として提出)を発表しました(以下、「プレスリリース」といいます)。
プレス・リリースを含め、本フォーム 8-K の項目 2.02 に記載された情報は、1934 年証券取引所法(改正後)第 18 条における「提出された」ものとはみなされず、また同法または 1933 年証券法(改正後)第 11 条および第 12 条(a)(2)の責任を問われるものでもありません。また、本情報は、米国証券取引委員会(以下「SEC」)に提出される当社のいかなる提出書類にも、当該提出書類に明示的に言及されている場合を除き、参照により組み込まれるものとはみなされません。
Item 8.01. Other Events
2025年8月7日、当社は最新のプレゼンテーション(以下「本プレゼンテーション」)をウェブサイトに掲載した。同プレゼンテーションの写しは別紙99.2としてここに提出され、参照することによりここに組み込まれる。
将来の見通しに関する記述についての注意事項
本Form 8-K最新報告書、プレスリリース、およびプレゼンテーションに記載されている一部の記述は、1995年米国私募証券訴訟改革法が定めるセーフハーバーの趣旨に照らし、重大なリスクと不確実性を伴う「将来の見通しに関する記述」です。本プレスリリースに含まれる、戦略、将来の事業運営、将来の財務状況、将来の収益、予測費用、現金および現金収支の十分性、予想される時期、臨床試験の開発および結果、見通し、計画、経営陣の目標に関する記述は、過去の事実に関する記述を除き、すべて将来の見通しに関する記述です。このような記述の例としては、当社の開発プログラムおよび対象疾患に関する記述、当社の開発プログラムが安全かつ効果的に疾患を対象とする可能性に関する記述、当社の開発プログラムに関する前臨床および臨床データなどが含まれますが、これらに限定されるものではありません;進行性多発性硬化症におけるvidofludimus calciumの第3相確認臨床試験への進展の可能性、現在および将来の臨床試験および予想される臨床マイルストーンのタイミング、当社の性質、戦略および焦点、ならびにそれらに関するさらなる更新、ならびに当社の製品候補の開発および商業的可能性。当社は、将来予想に関する記述で開示された計画を実際に達成したり、意図を実行したり、期待や予測を達成したりしない可能性があり、これらの将来予想に関する記述を過度に信頼すべきではありません。このような記述は、経営陣の現在の予想に基づくものであり、重大なリスクと不確実性を伴います。インフレ率の上昇、関税およびマクロ経済動向、ウクライナ・ロシア紛争および中東紛争が計画中および進行中の臨床試験に及ぼす影響、将来の現金利用率および偶発的な将来債務や事業運営に必要な準備金を予測する能力に関連するリスクおよび不確実性、事業目標および事業要件を満たすための十分な財務およびその他の資源の利用可能性など(ただし必ずしもこれらに限定されない)、多くの要因の結果として、実際の結果および業績は、将来見通しに関する記述で予測されたものとは大きく異なる可能性があります、また、継続企業の前提条件として十分な資本を調達する能力、初期の前臨床試験や臨床試験の結果が将来の臨床試験結果を予測できない可能性があること、当社の製品または製品候補の標的市場の規模に変化が生じた場合、当社の知的財産による保護と市場独占権、医薬品開発および規制当局の承認プロセスに関するリスク、競合製品や技術革新の影響などです。これらのリスク、不確実性およびその他の要因の詳細なリストおよび説明は、2025年3月31日にSECに提出された当社の2024年12月31日終了会計年度の年次報告書(フォーム10-K)およびその後のSECへの提出書類の「リスク要因」のセクションに記載されています。これらの提出書類のコピーは、www.sec.gov または ir.imux.com/sec-filings からオンラインで入手できます。
本Current Report on Form 8-K、プレスリリースおよびプレゼンテーションに記載された記述は、本書に記載された日付現在のものであり、その後の事象や展開により、当社の期待や確信が変更される可能性があります。当社は、将来のある時点で、これらの将来予想に関する記述を更新することを選択する可能性がありますが、当社は、法律で義務付けられている場合を除き、新たな情報、将来の出来事、またはその他の結果にかかわらず、その義務を明確に否認します。これらの将来見通しに関する記述は、ここに記載された日付以降の当社の見解を表すものとして依拠すべきではありません。
Item 9.01. 財務諸表および添付資料
| Exhibit | Description |
| 99.1 | 2025年8月7日付プレスリリース。 |
| 99.2 | 2025年8月7日付プレゼンテーション。 |
| 104 | 本current report on form 8-kのインラインxbrlによるカバーページ。 |
SIGNATURES
1934年証券取引所法(改正後)の要件に従い、登録者は本報告書に正式に権限を付与された署名者により、登録者を代表して署名させた。
| Dated: August 7, 2025 | Immunic, Inc. | |
| By: | /s/ Daniel Vitt | |
| Daniel Vitt | ||
| Chief Executive Officer | ||

イミュニック・インク2025年第2四半期決算報告と最新情報のお知らせ
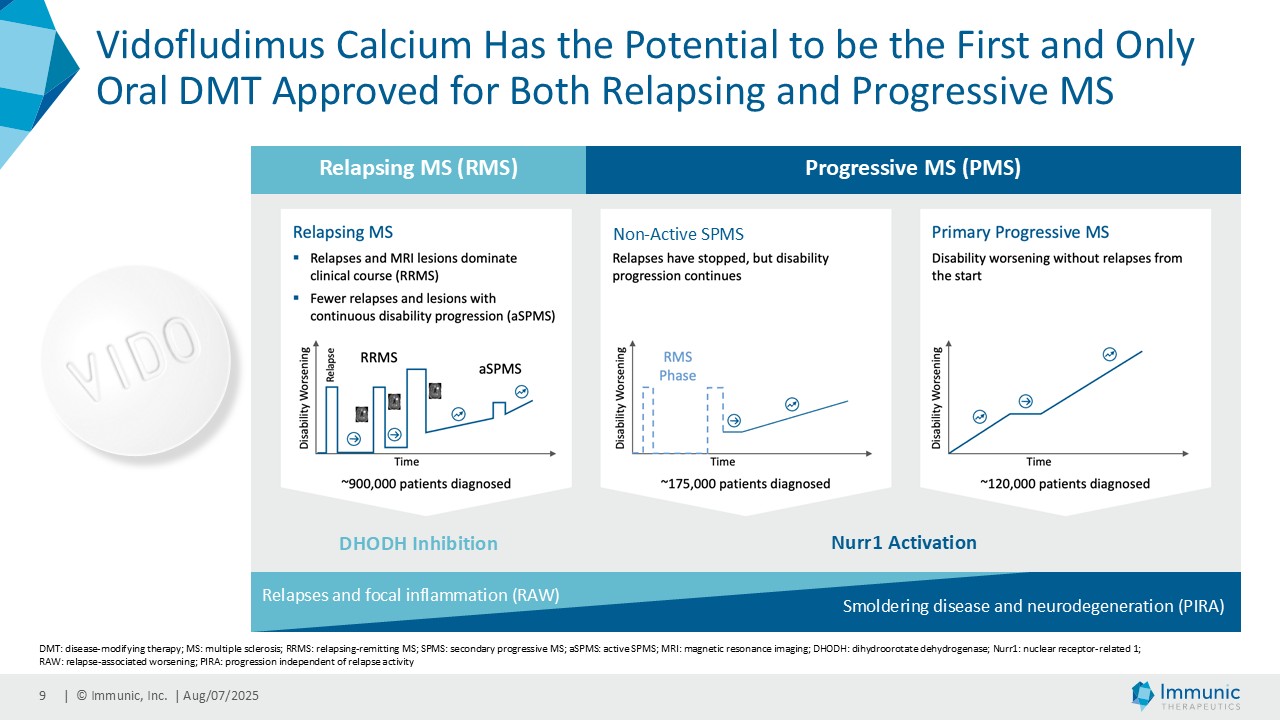
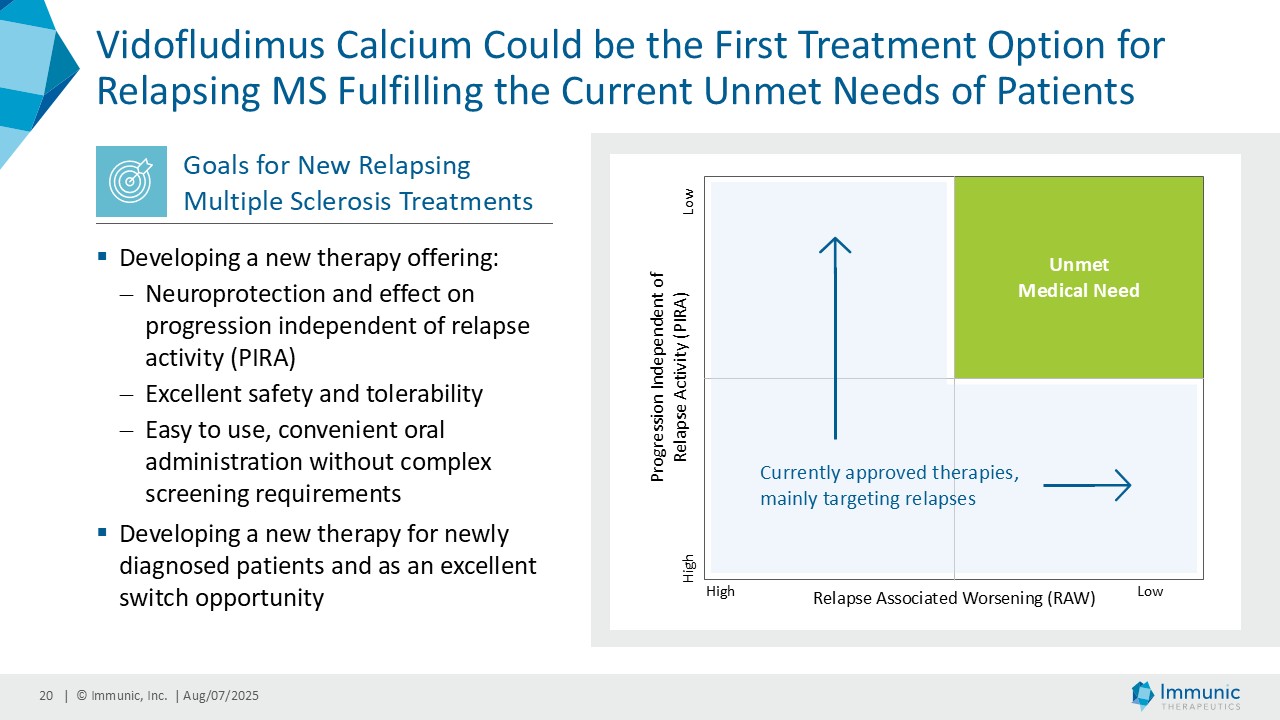
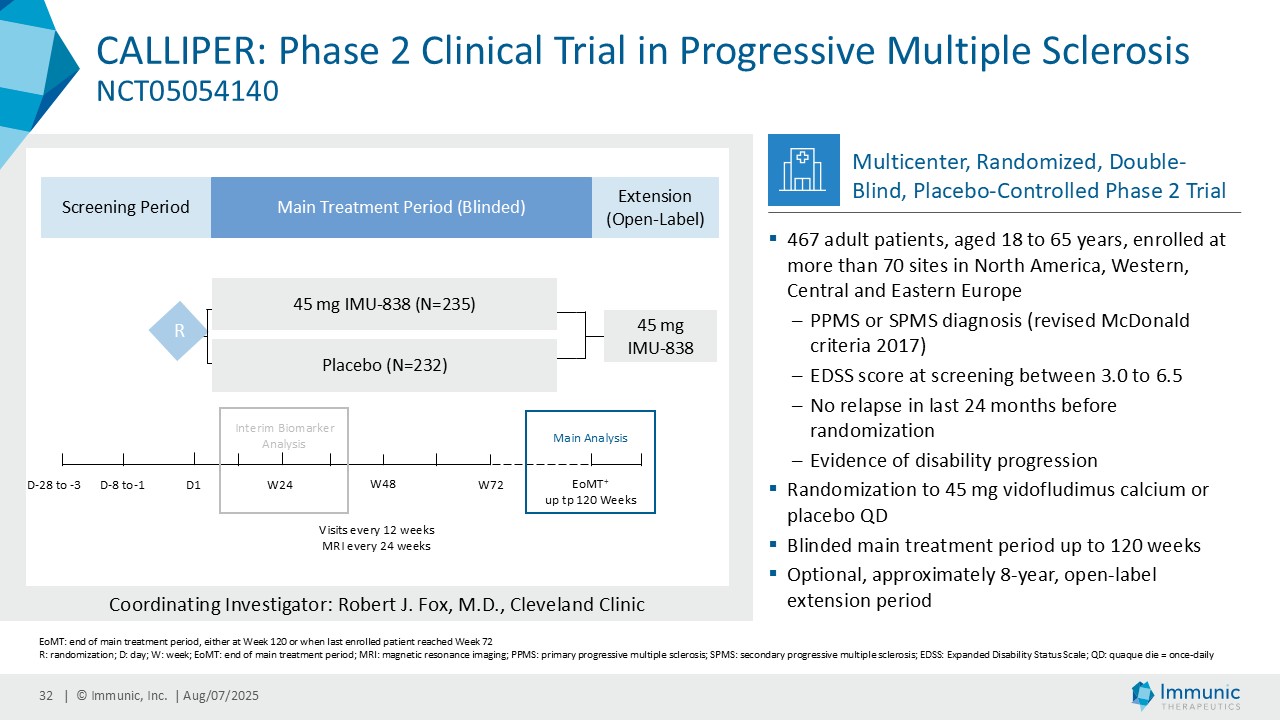
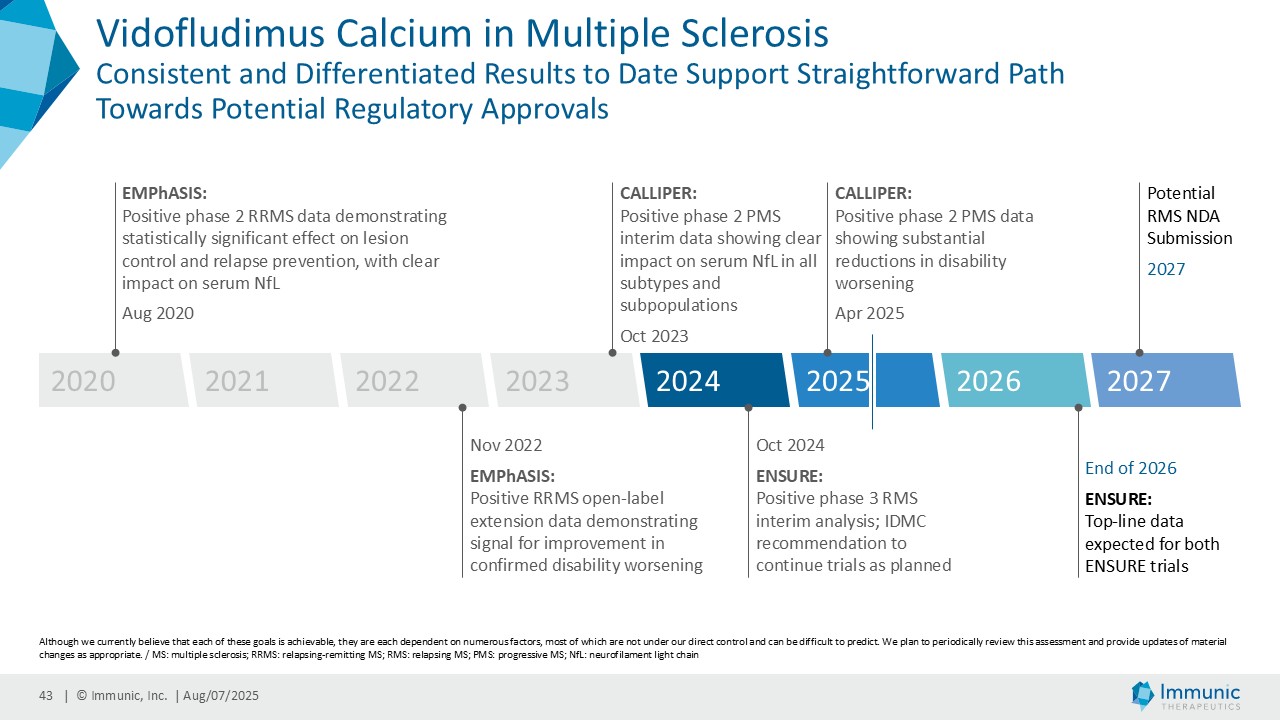
– ビドフルジムス・カルシウムは、進行性多発性硬化症全体を対象とした第 2 相臨床試験 CALLIPER において、サブタイプを問わず、24 週間の確認された障害の悪化を大幅に抑制し、本薬の神経保護ポテンシャルと疾患の進行を遅らせる能力を補強した-。
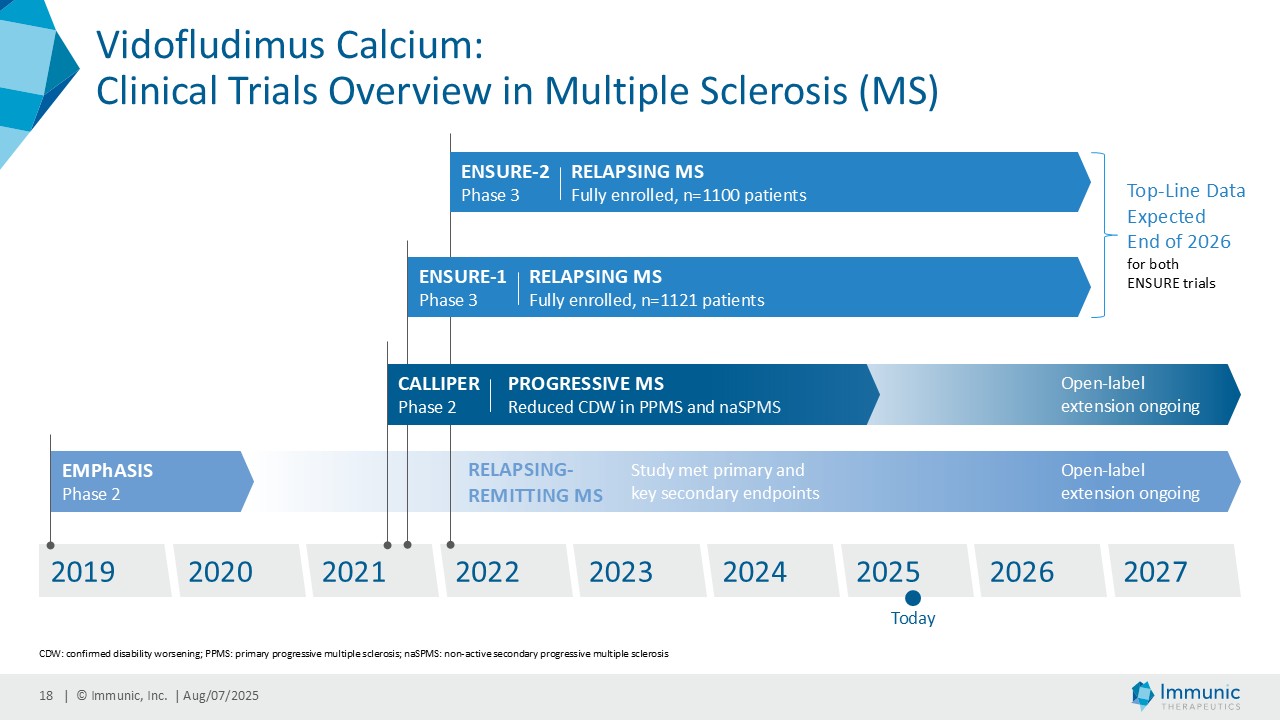
– ビドフルジムス・カルシウムの再発性多発性硬化症を対象とした臨床第3相試験ENSUREの両試験の登録が完了、2026年末までにトップラインデータを取得予定 -|ニュースリリース|大日本住友製薬
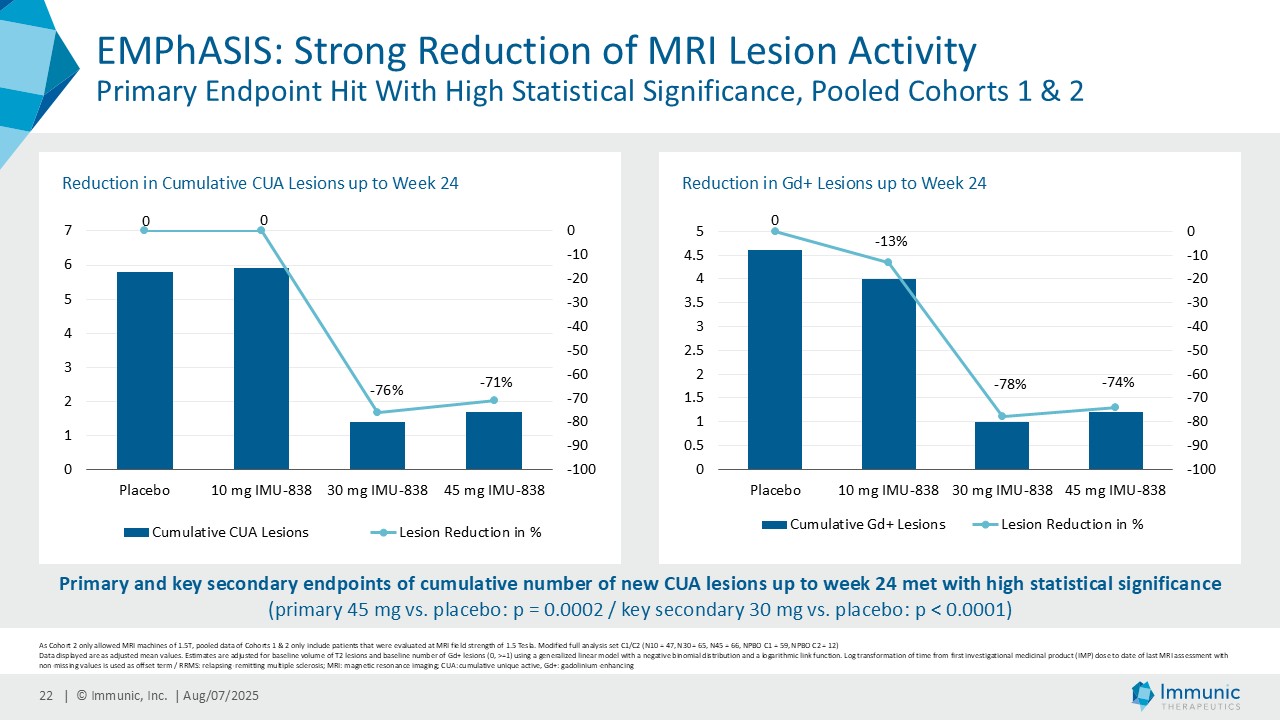
– 再発寛解型多発性硬化症を対象とした臨床第2相試験EMPhASISの新たな長期非盲検延長データにより、12週および24週の障害の悪化が確認されなかった患者の割合が高いことが示される - 日本経済新聞
- 2件の資金調達で総額7,010万ドルを調達し、バランスシートを強化。
ニューヨーク、2025年8月7日-慢性炎症性疾患および自己免疫疾患に対する経口低分子治療薬の臨床パイプラインを開発中のバイオテクノロジー企業、イムニック・インク(Nasdaq: IMUX)は本日、2025年6月30日に終了した第2四半期および6カ月間の決算を発表し、企業最新情報を提供した。
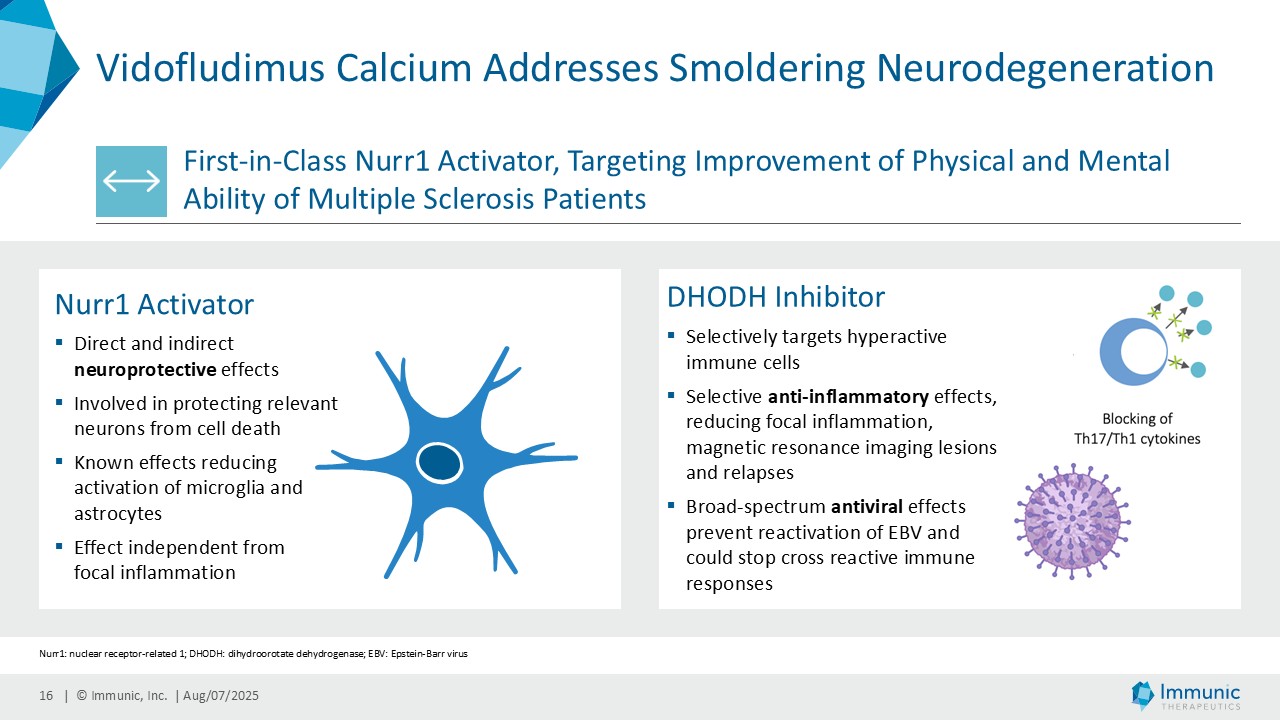
「イミュニックの最高経営責任者(CEO)であるダニエル・ヴィット博士は、次のように述べています。 「第2四半期から最近にかけて、私たちは、革新的な可能性を秘めたリード化合物である経口核内受容体関連 1(Nurr1)活性化剤ビドフルジムス・カルシウム(IMU-838)の開発において、大きな進展を遂げました。「最も注目すべきは、双子の第3相ENSURE試験の登録が予定通り完了したことで、再発性多発性硬化症(RMS)の患者さんに対する新たな治療選択肢の提供に一歩近づいたことです。また、これまでに認められた独自の神経保護作用は、第3相ENSURE試験でも確認された障害の悪化を解析するための裏付けとなります。2026年末までに予定されている両試験のトップラインデータにより、この臨床エンドポイントの同期読み出しとプール解析が可能になる。ビドフルジムス・カルシウムは、神経保護作用、抗炎症作用、抗ウイルス作用の明確な組み合わせが認められ、安全性と忍容性のプロファイルも確立されており、承認されれば、多発性硬化症(MS)の複雑な病態生理に対応する差別化された経口治療薬として登場する可能性があります。"
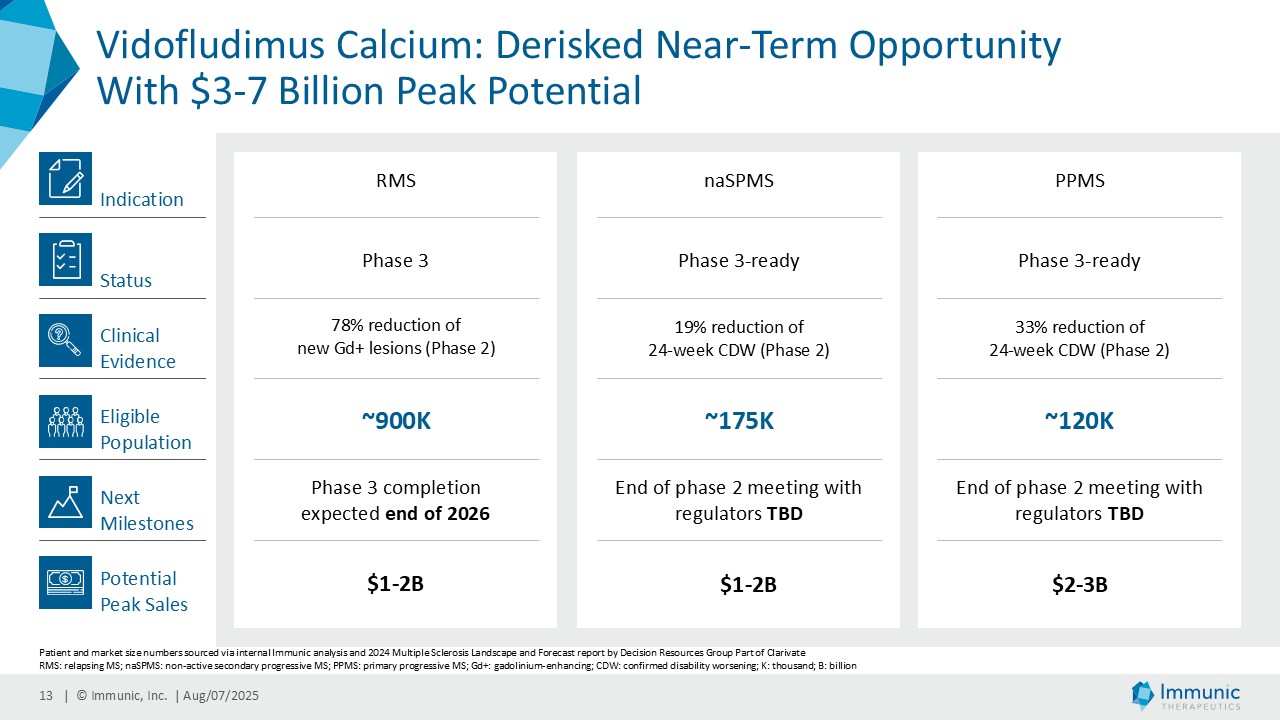
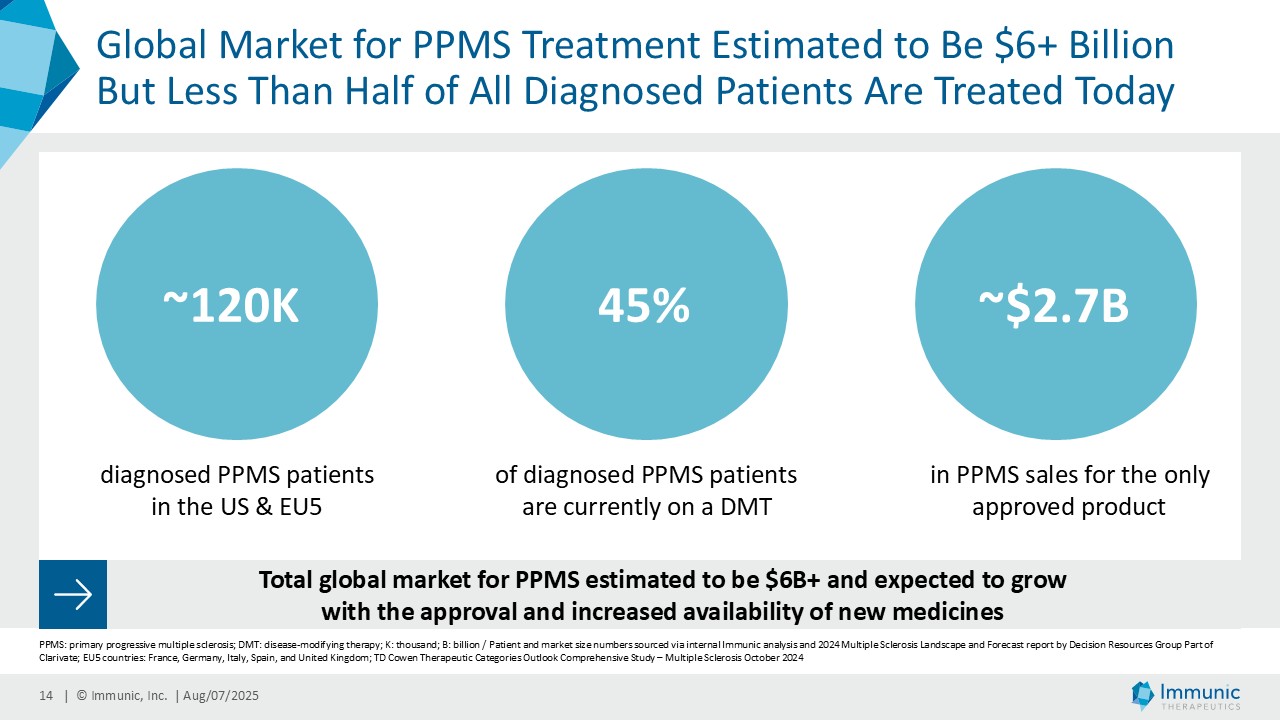
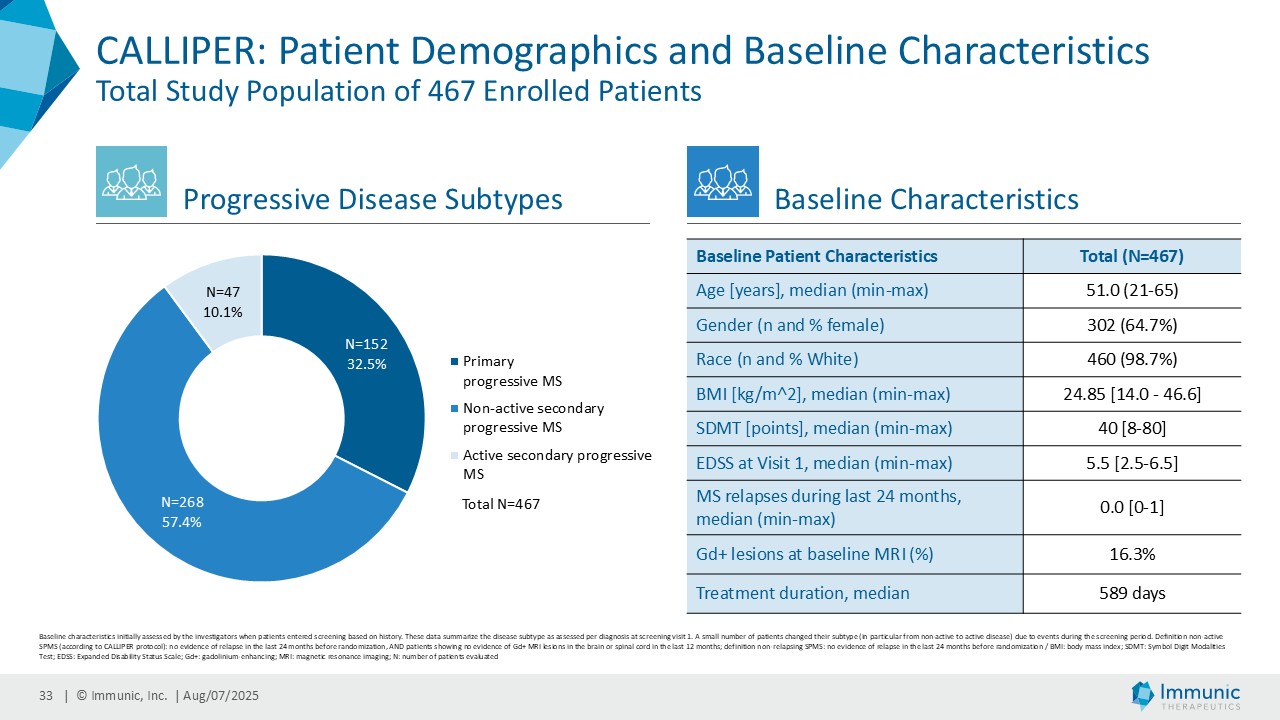
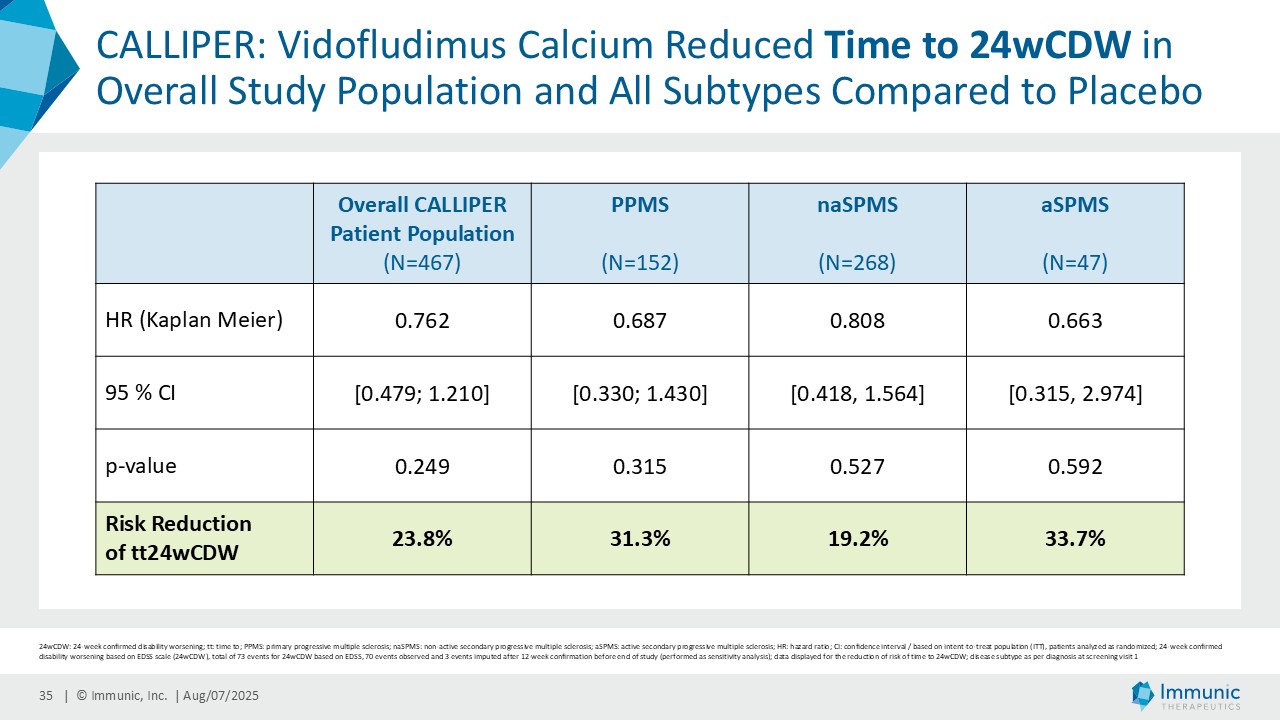
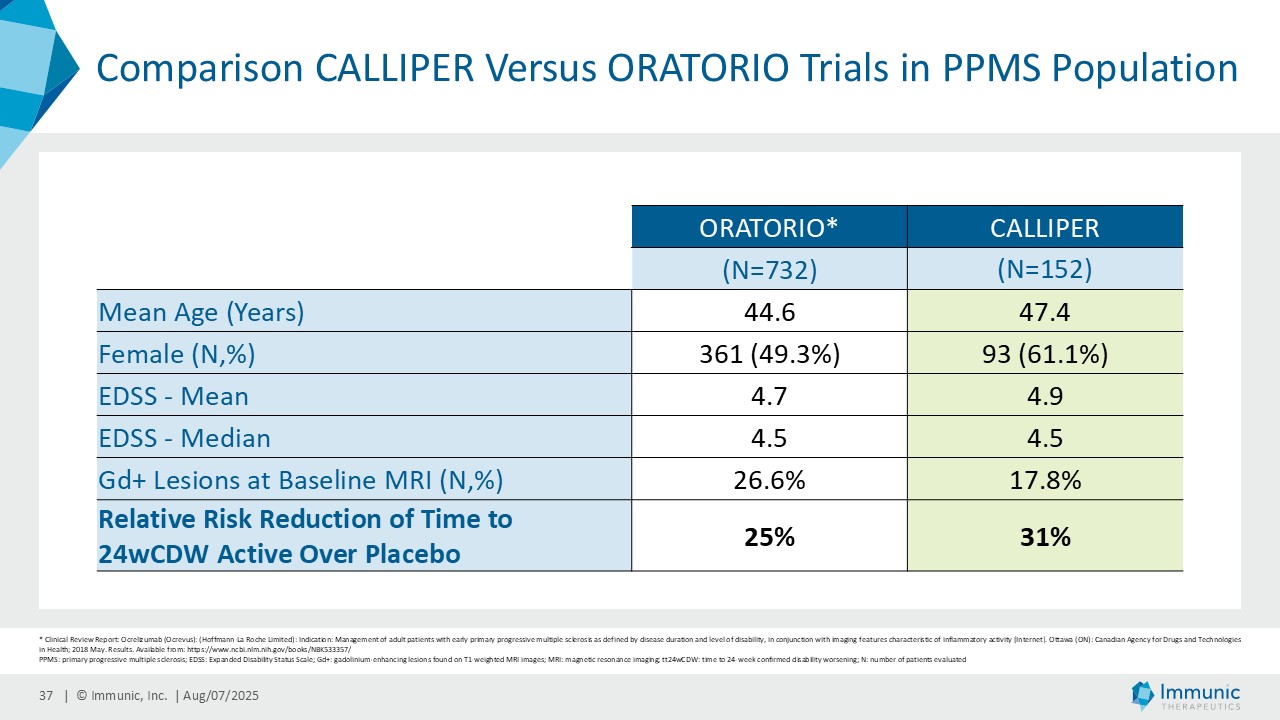
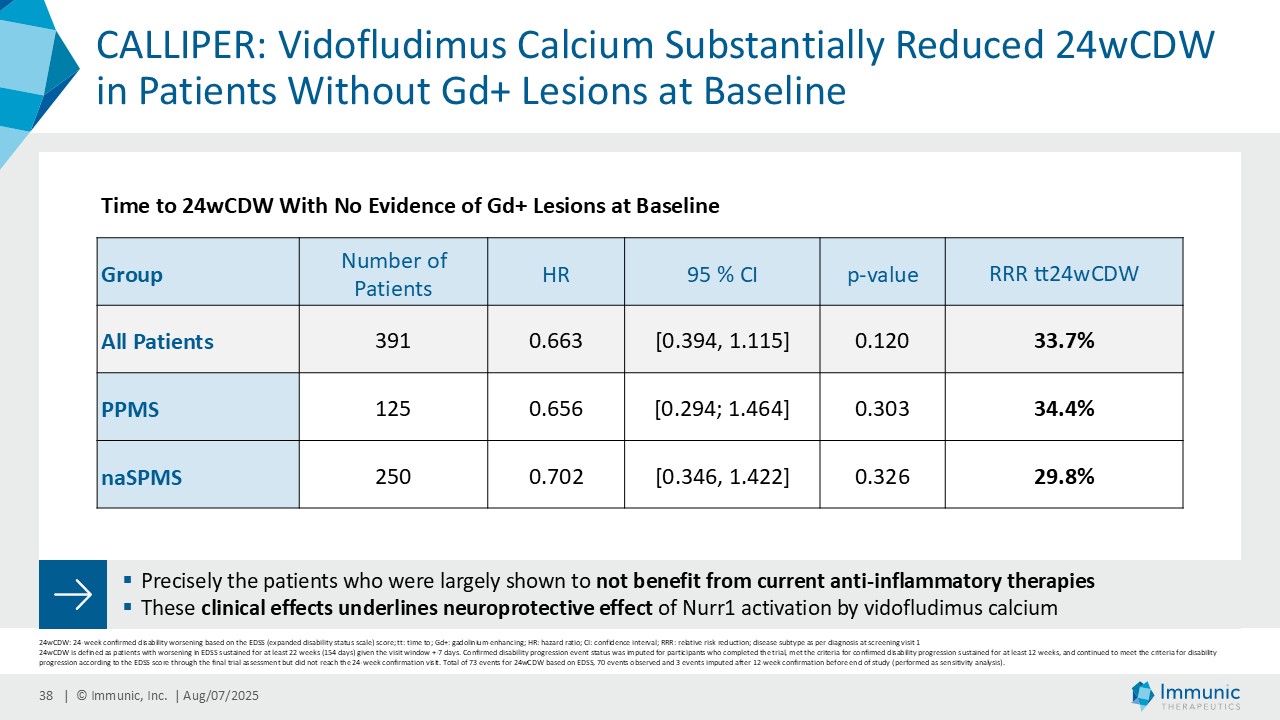
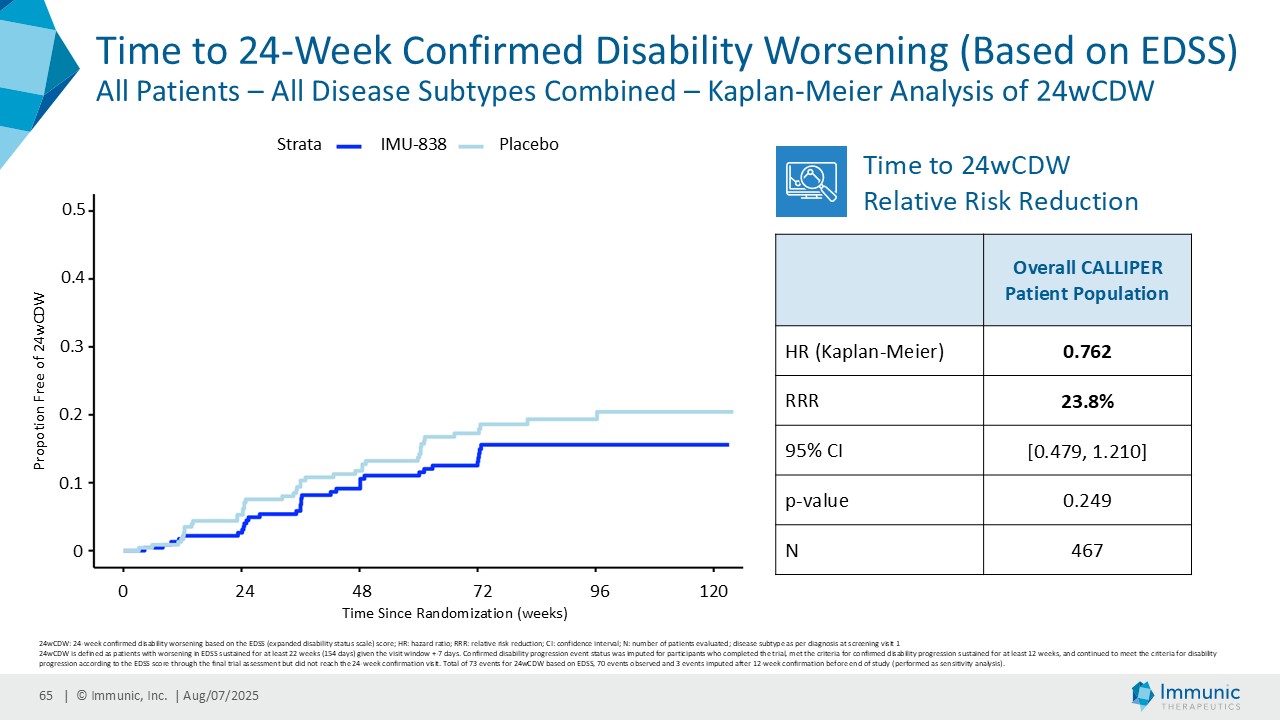
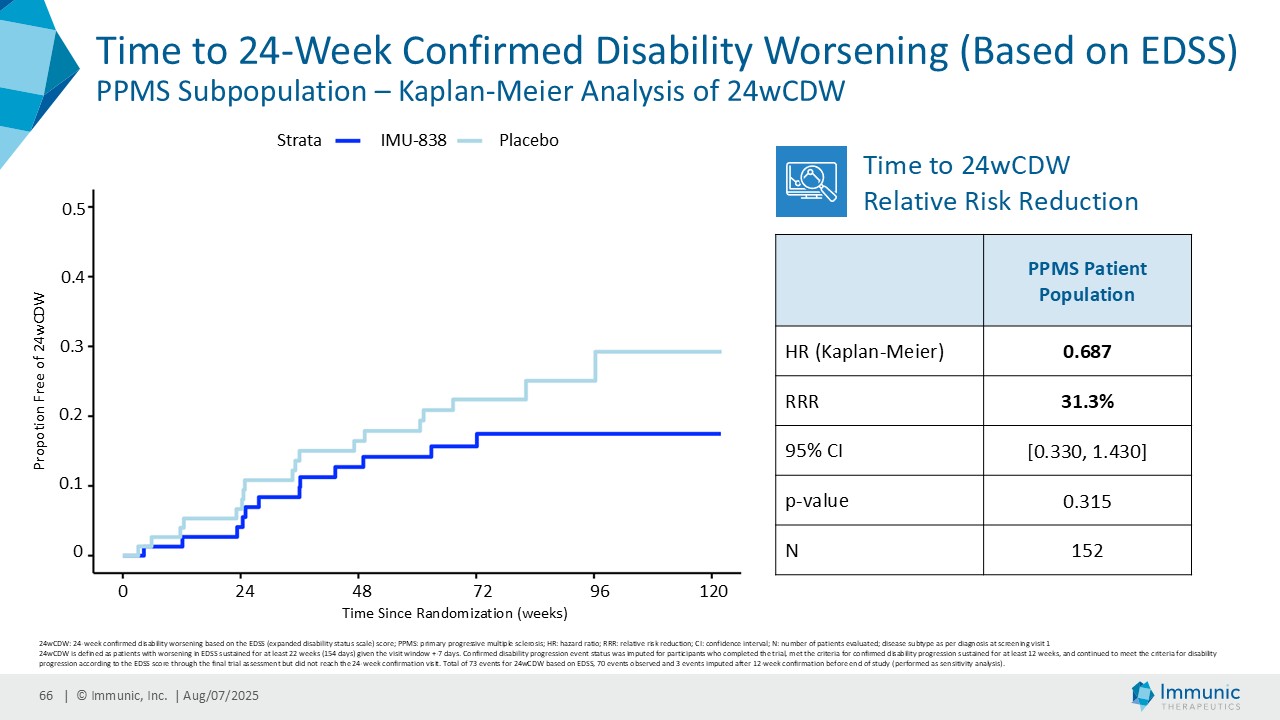
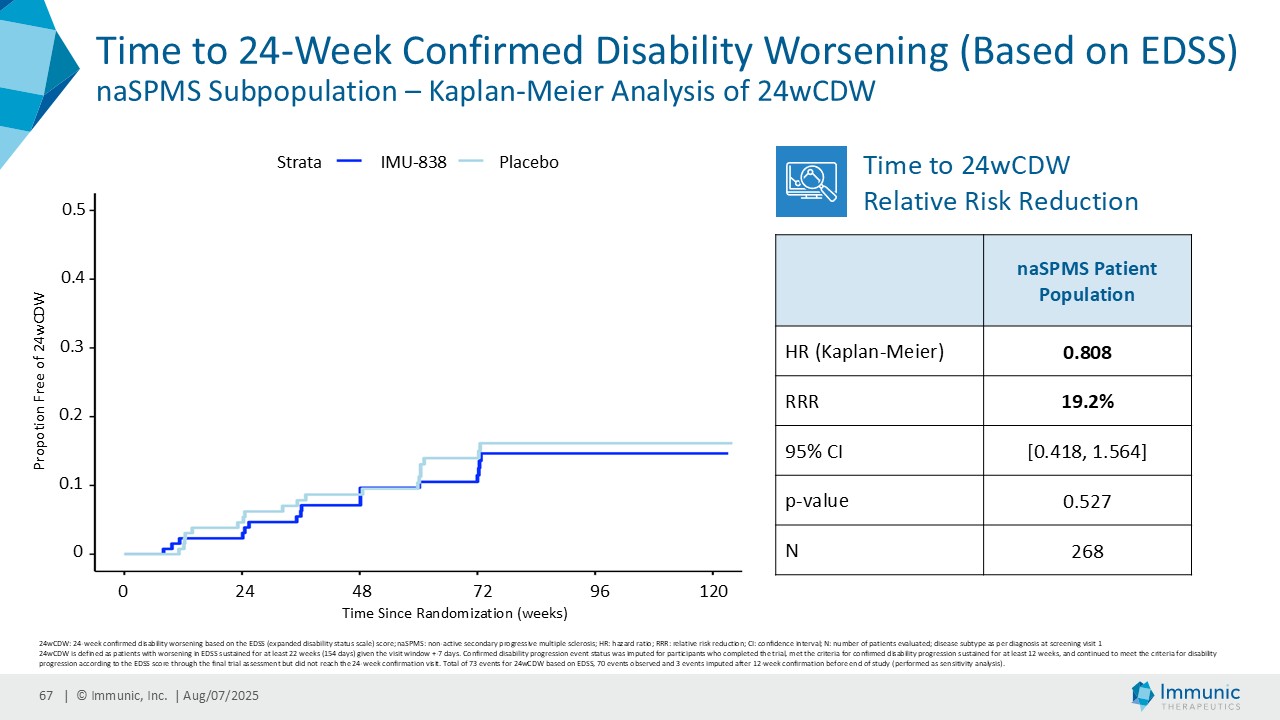
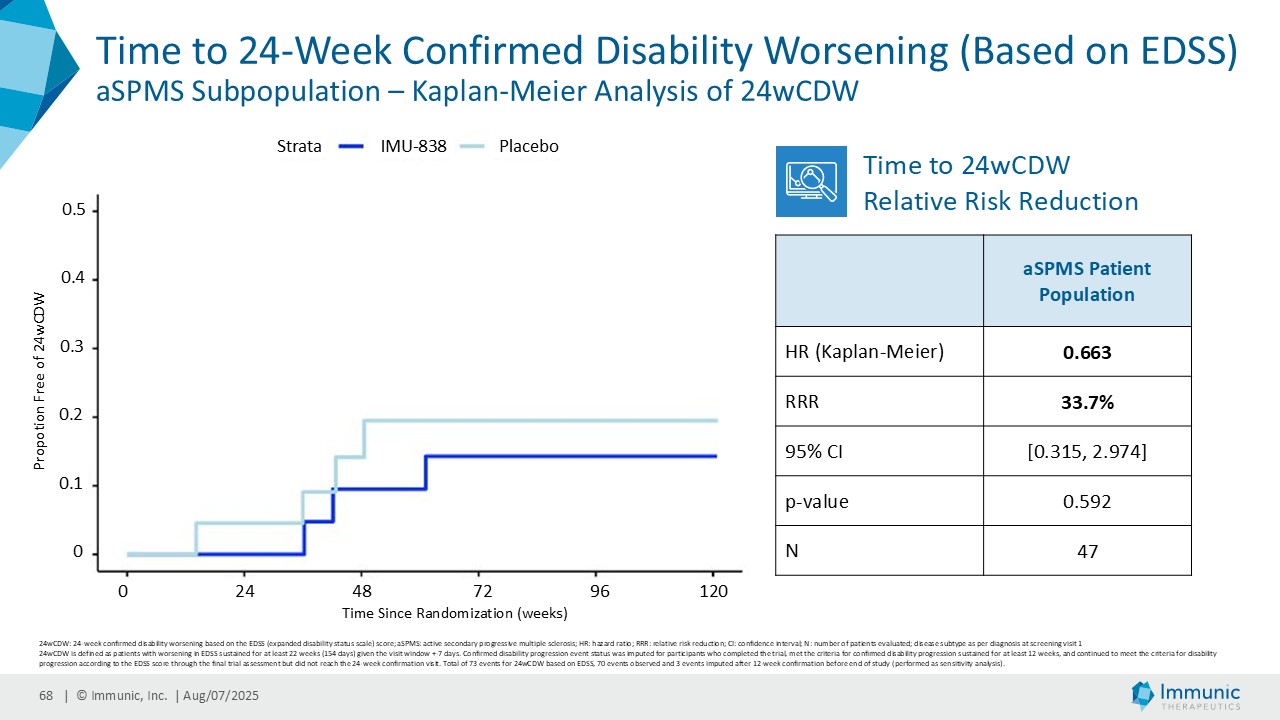
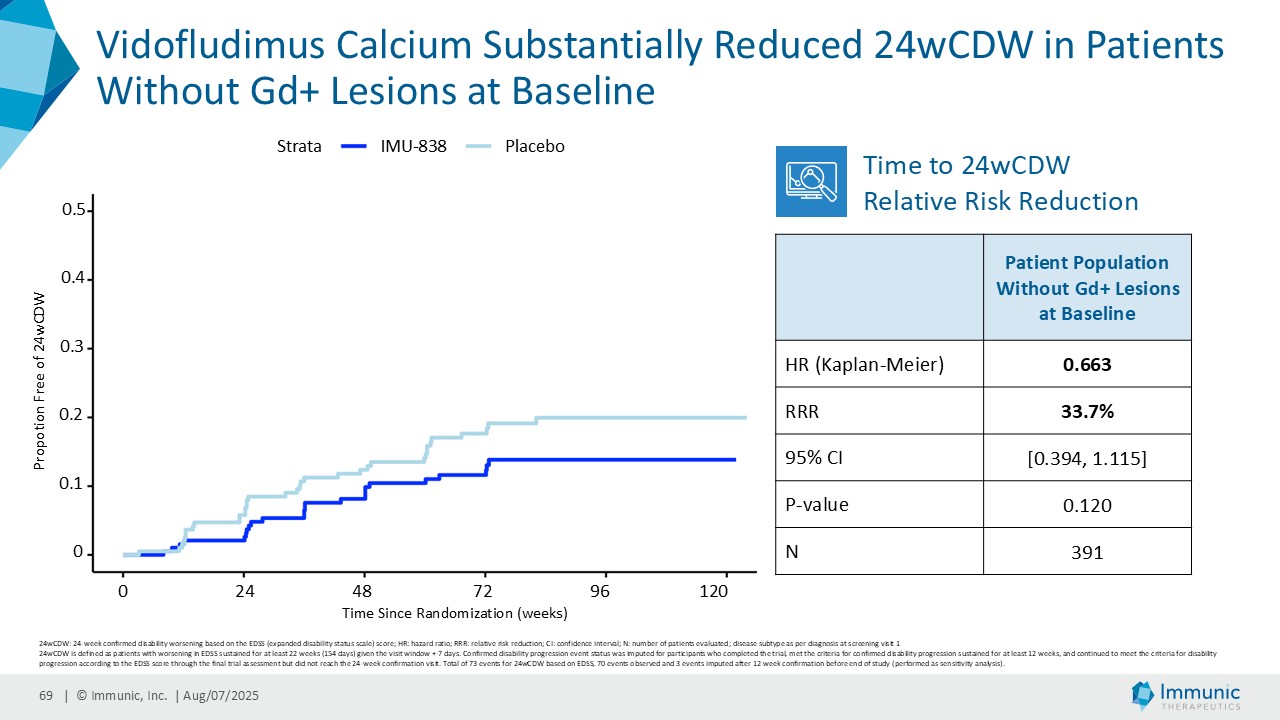
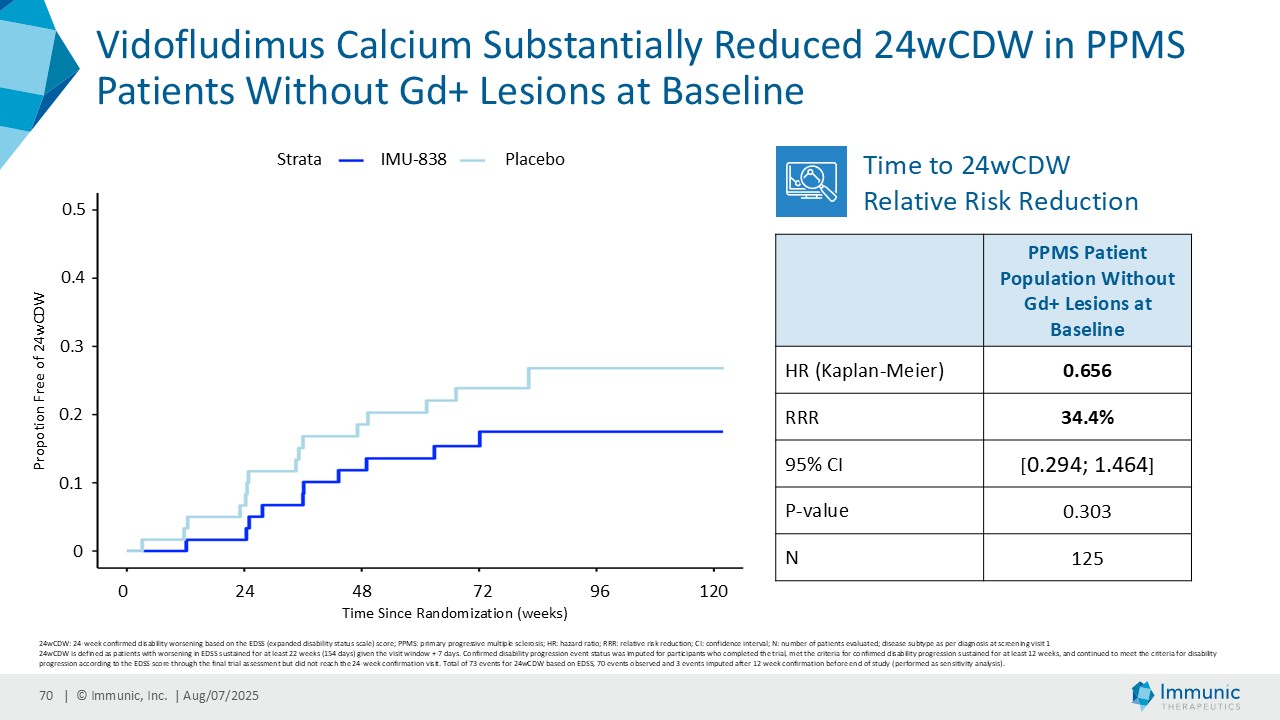
「進行性多発性硬化症(PMS)を対象とした第 2 相 CALLIPER 試験では、プラセボと比較して、24 週間の障害悪化が確認されるまでの期間(24wCDW)が 23.8%短縮しました。アンメットニーズの高い一次進行性MS(PPMS)のサブグループでは、この効果は31.3%で、これまでのPPMS試験で観察された結果を上回った。もう一つのアンメットニーズの高いサブタイプである非活性型SPMS(naSPMS)では、19.2%の減少がみられた。さらに、ベースライン時にガドリニウム増強病変がなく、既存の治療法では効果が得られないことが多い患者において、24wCDWの減少はPMS全体で33.7%、PPMSとnaSPMSのサブグループでそれぞれ34.4%と29.8%であった。24wCDWまでの時間は、PMSにおける臨床的有用性を評価するための薬事規制上のエンドポイントとして認められているため、これらの知見は、ビドフルジムス・カルシウムを進行型MSの第3相開発に進めることを強く支持するものだと考えています。現在、PPMSには承認された治療薬が1つしかないため、ビドフルジムスカルシウムは、60億ドル以上の十分な治療を受けていないこの市場にとって、非常に有望な選択肢となる可能性があります。

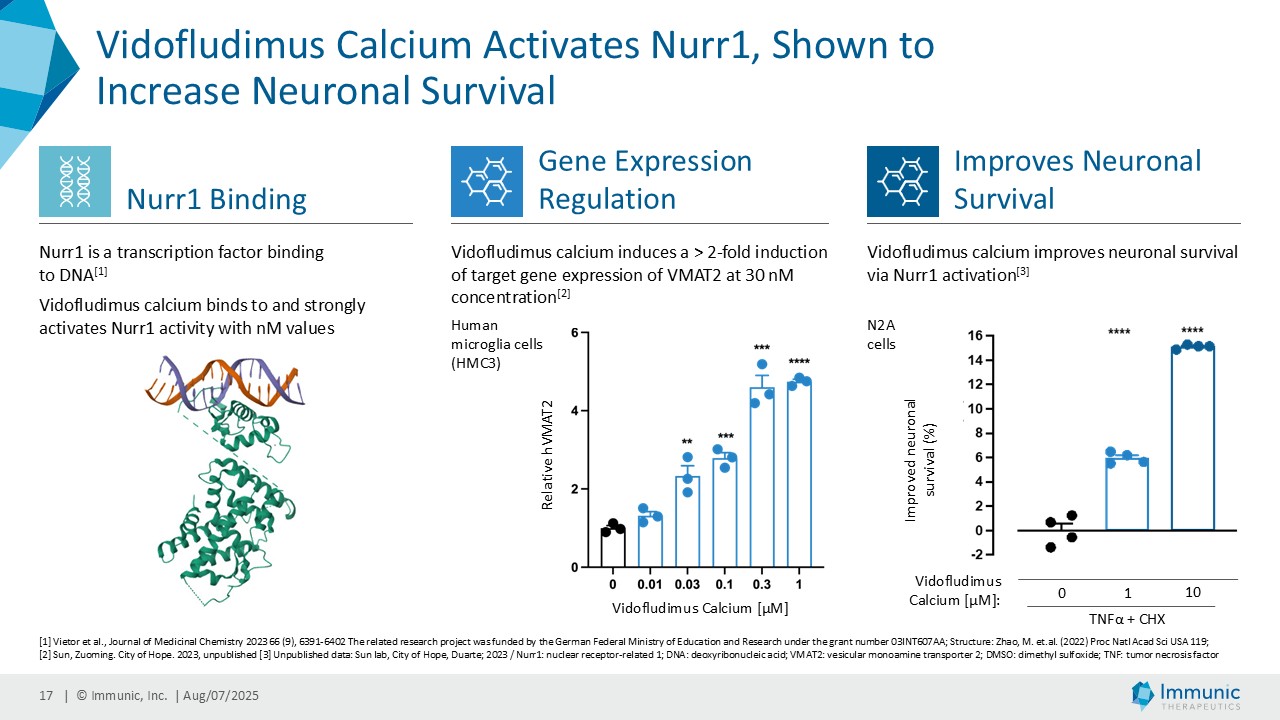
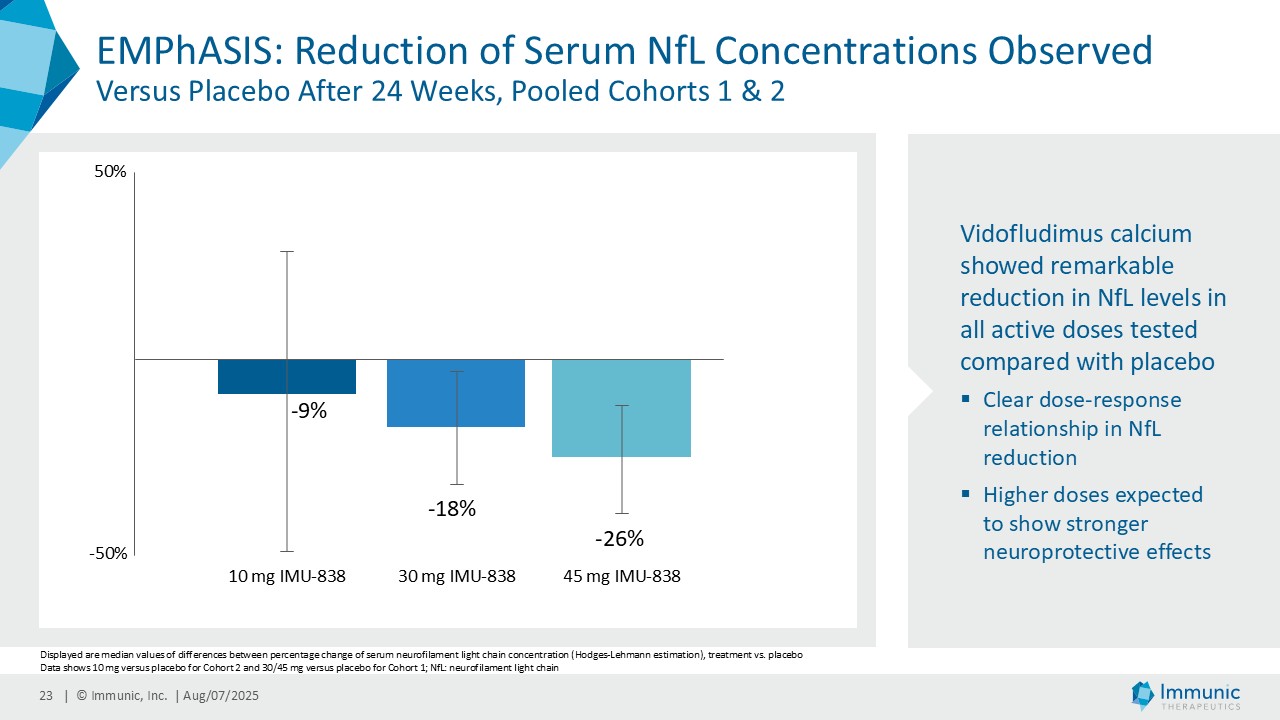
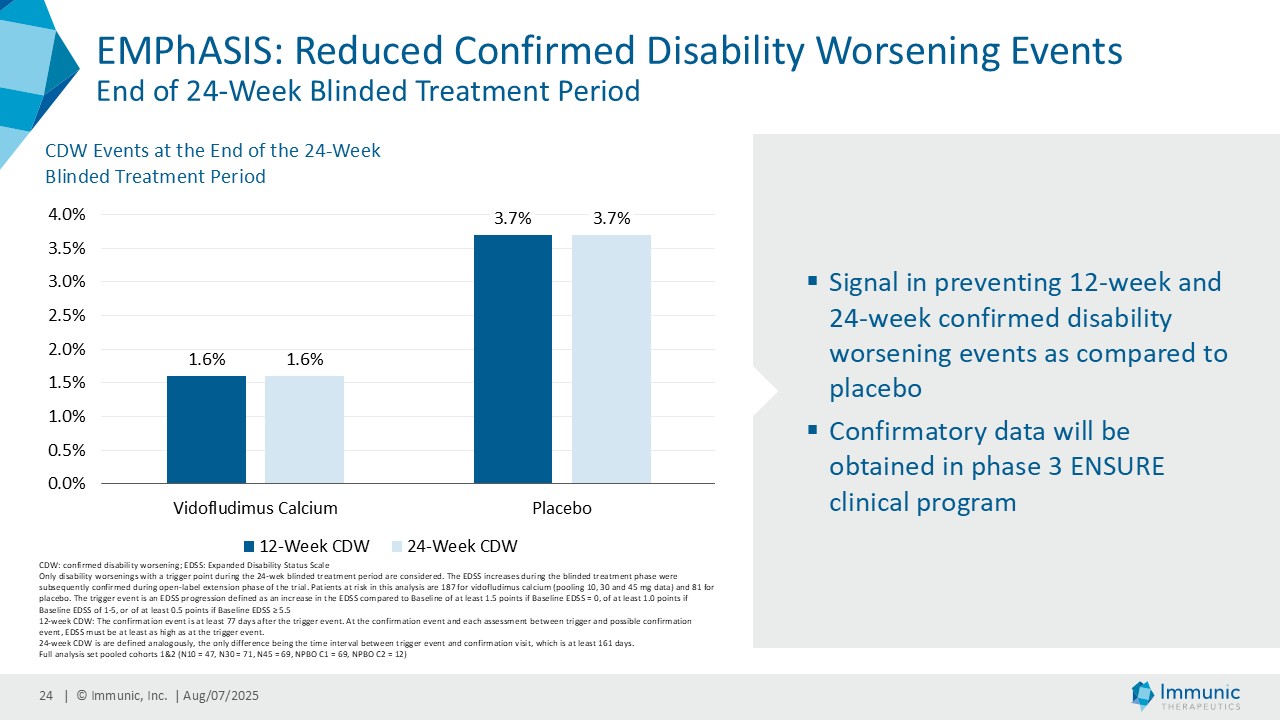
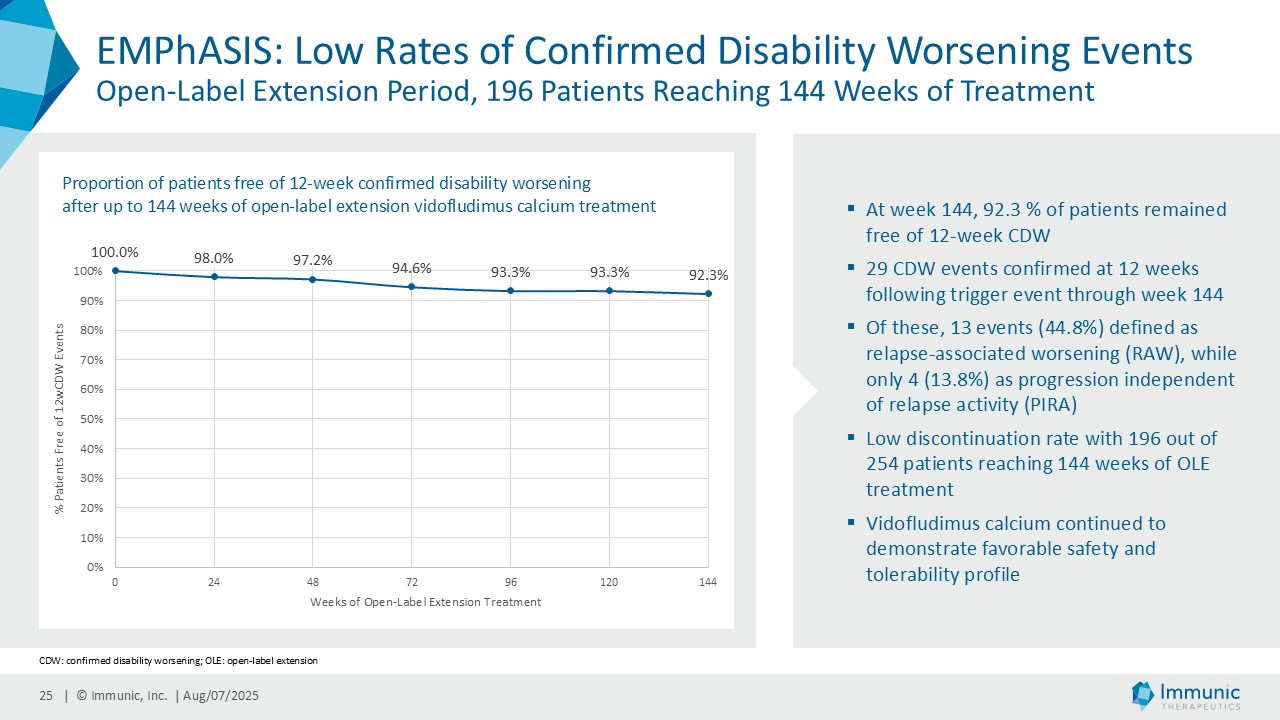
経営陣は、ビドフルジムス・カルシウムの良好なデータが続いている中で、再発寛解型多発性硬化症(RRMS)を対象とした臨床第2相試験EMPhASISの長期非盲検延長試験(OLE)から新たなデータが得られ、この試験で以前に認められた強い有効性シグナルがさらに強化されたことを指摘した。データによると、144週目の時点で92.3%の患者が12週目の障害悪化(12wCDW)を認めず、92.7%が24wCDWを認めなかった。この結果と、EMPhASISおよびCALLIPERのトップラインデータを含むMSプログラム全体の既発表結果は、ビドフルジムスカルシウムの疾患進行を遅らせる可能性をさらに裏付けるものである。これらの知見はまた、Nurr1標的の活性化を介して介在すると考えられる神経保護作用を引き続き強調しています。データの強さに基づき、9月に開催される第41回欧州多発性硬化症治療研究委員会(ECTRIMS)において、口頭発表1演題、後期ポスター発表1演題を含む計5演題の発表が決定しており、これは当社にとって大きな成果である。
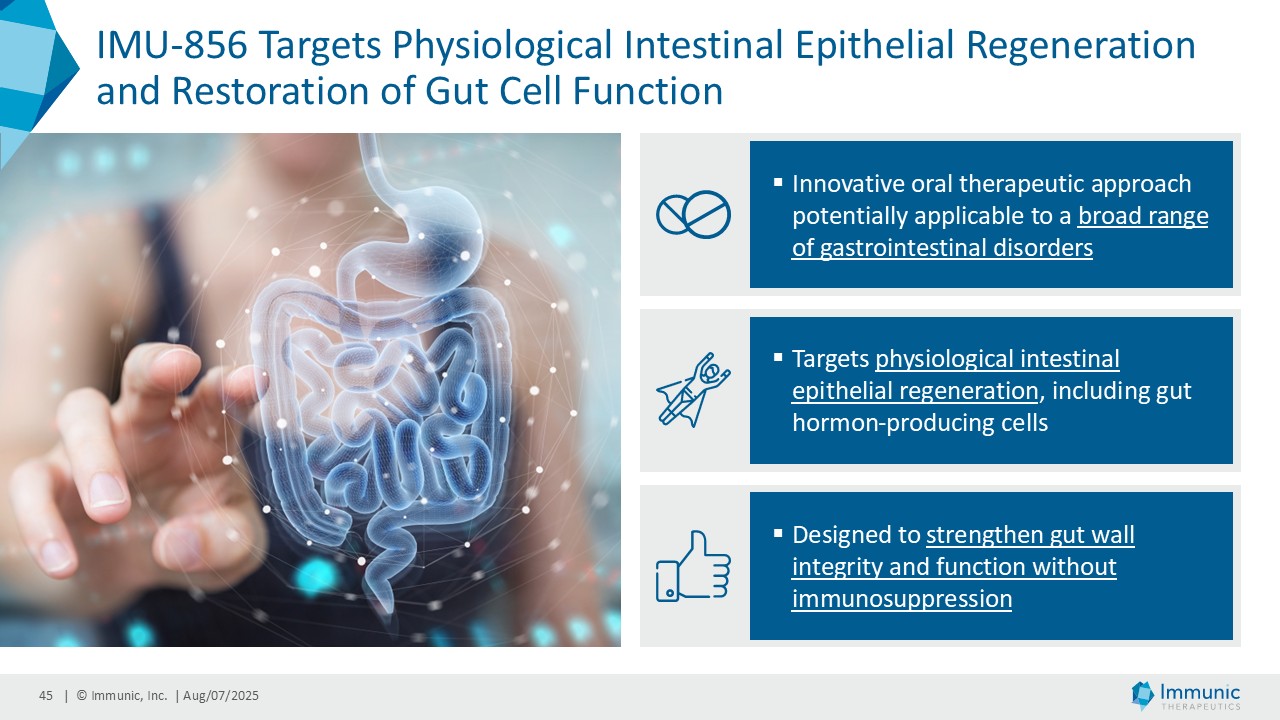
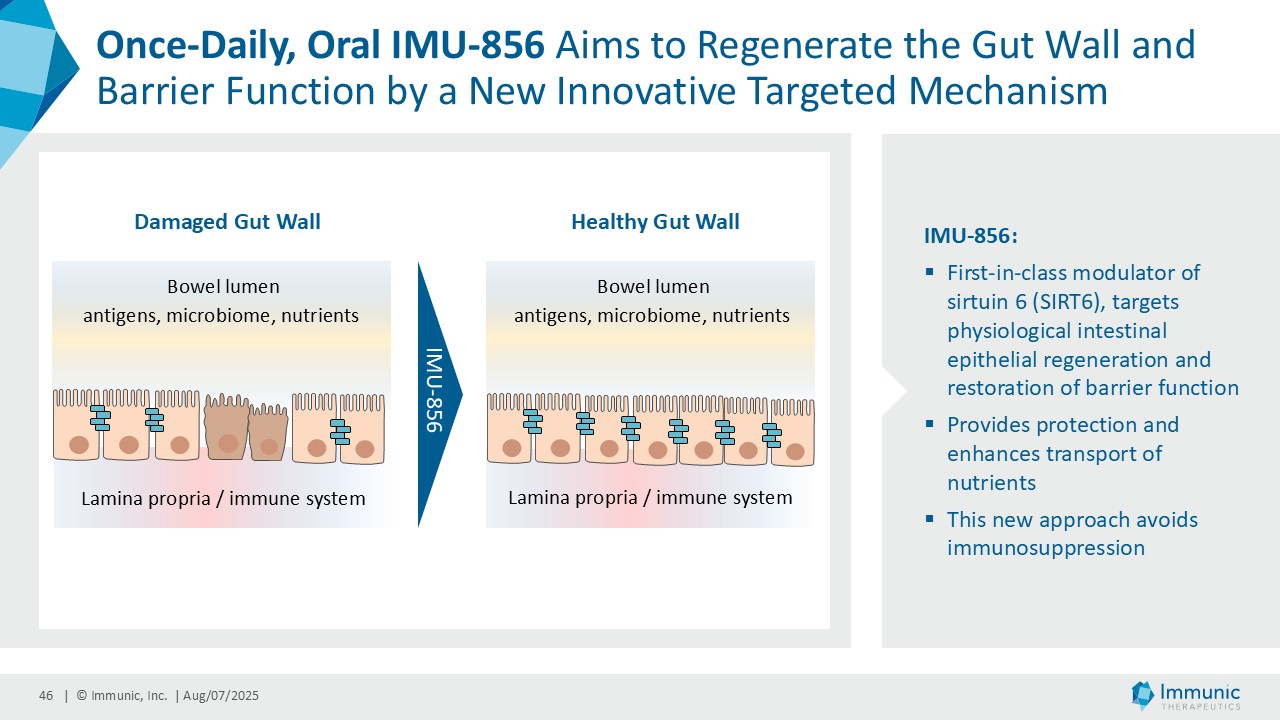
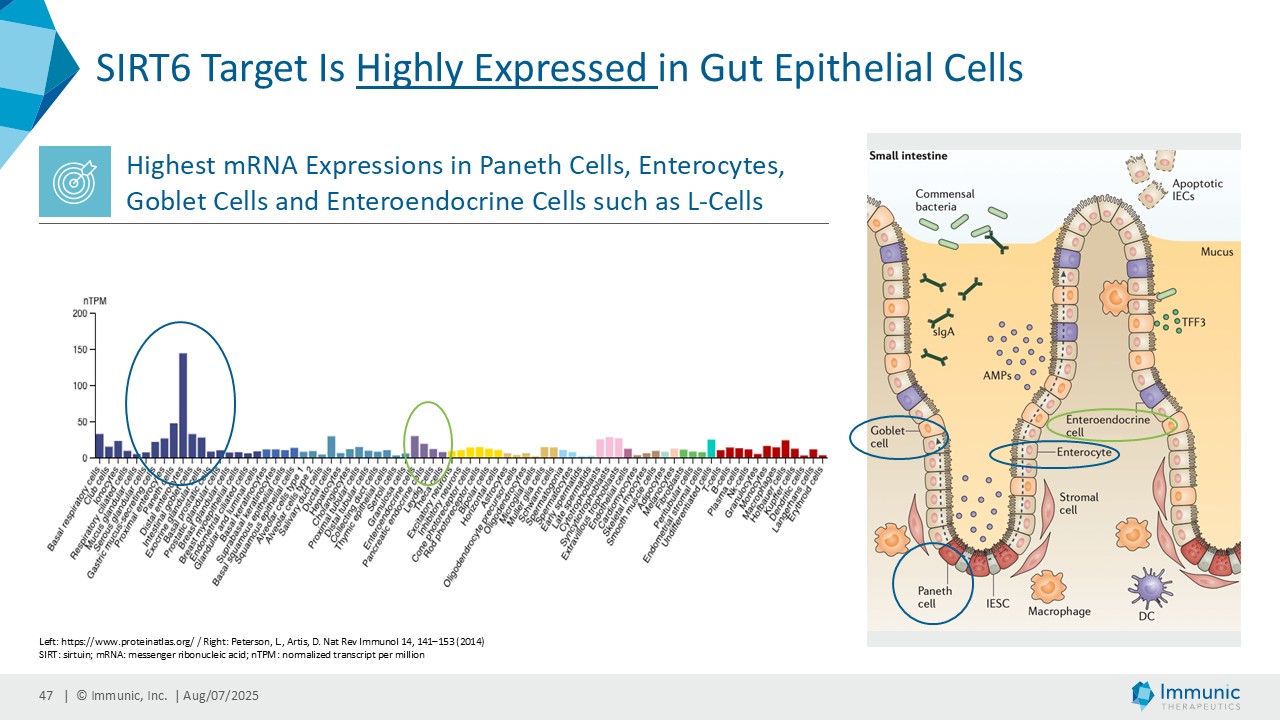
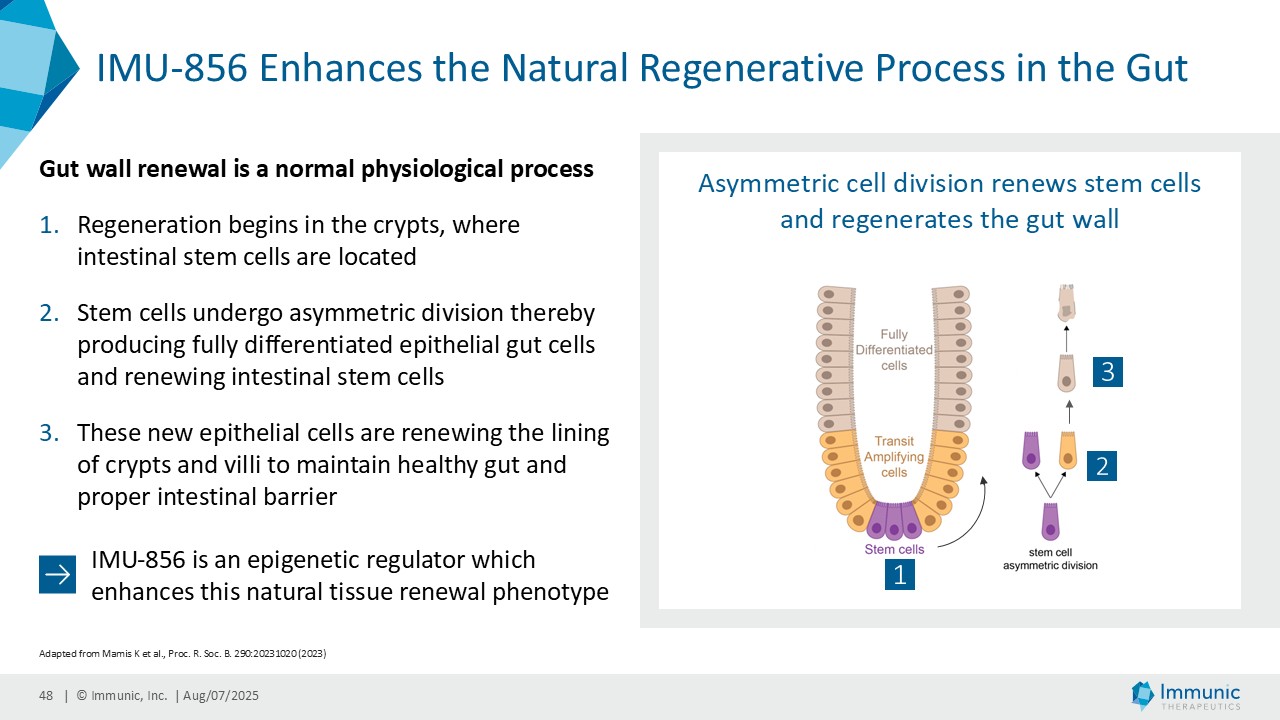
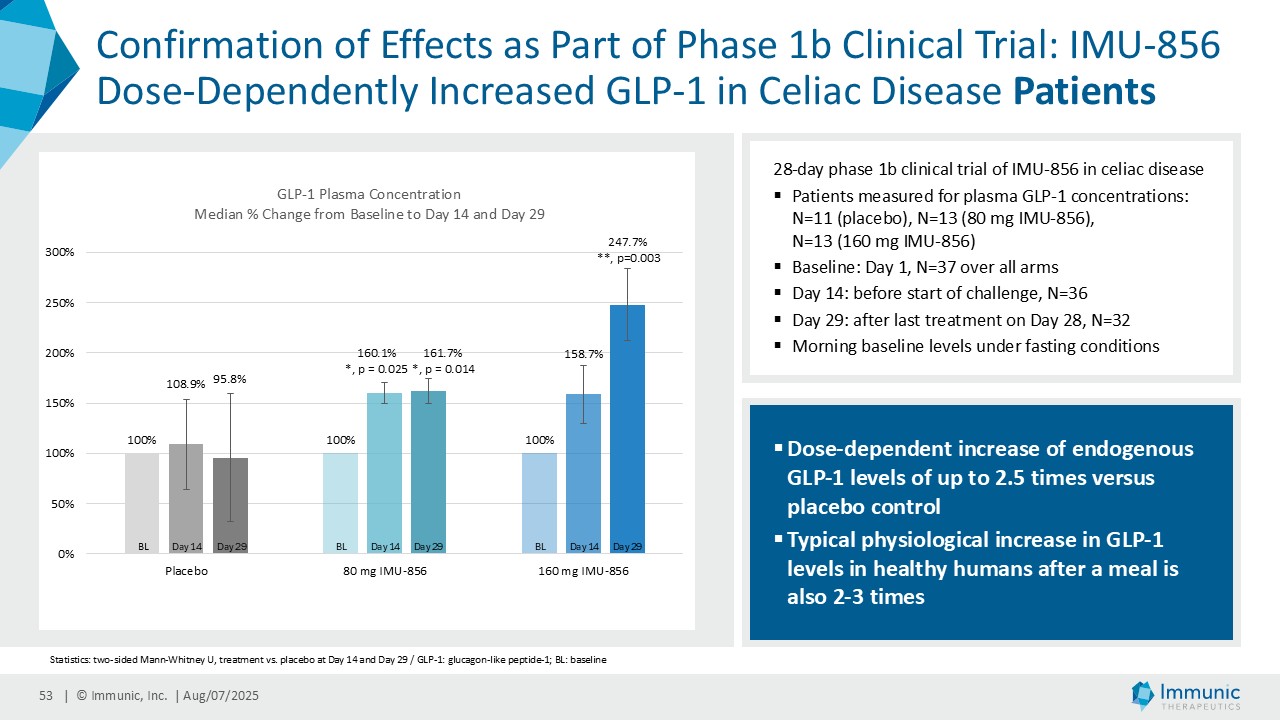
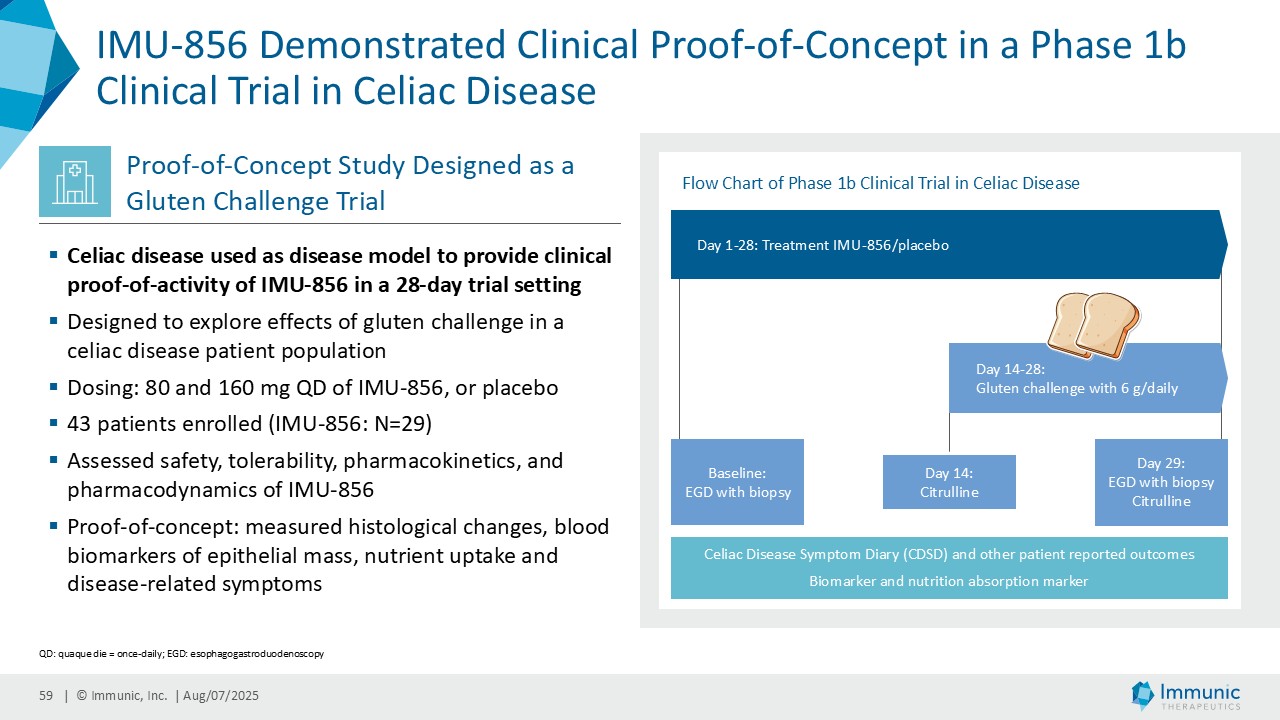
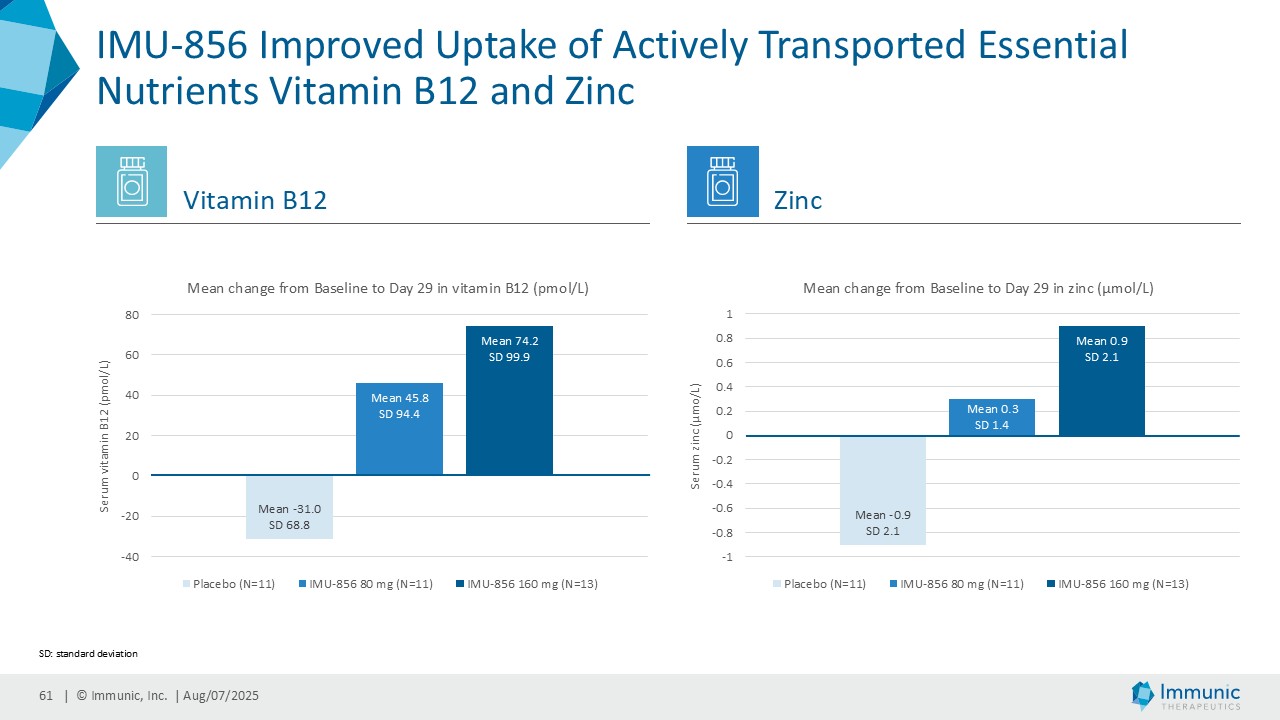
ヴィット博士は、「ヴィドフルジムス・カルシウム以外にも、経口投与が可能で全身に作用する、サーチュイン6(SIRT6)を標的とする低分子モジュレーターであるIMU-856の説得力のある臨床データおよび前臨床データは、この薬剤が消化器疾患の新規治療薬となる可能性が高いことを示しています。現在までに得られた有望なデータに基づき、当社はさらなる臨床試験の準備を進めるとともに、本プログラムを推進するための資金調達、ライセンス供与、提携の可能性を探っています。さらに、IMU-856は体重管理の経口治療薬としての可能性も示しています。具体的には、当社の第1b相臨床試験結果の事後分析において、空腹時のセリアック病患者において、GLP-1レベルがプラセボに対して最大250%上昇したことが示されており、これは食後の自然な反応を模倣したものであり、IMU-856が生理学的に腸内分泌経路を活性化し、現行のインクレチン模倣注射薬よりも幅広いメカニズムを提供する可能性を示唆しています。今後の臨床試験で検証されれば、この1日1回経口投与の低分子は、体重管理のための便利な代替治療薬となる可能性がある。"
2025年第2四半期とその後のハイライト
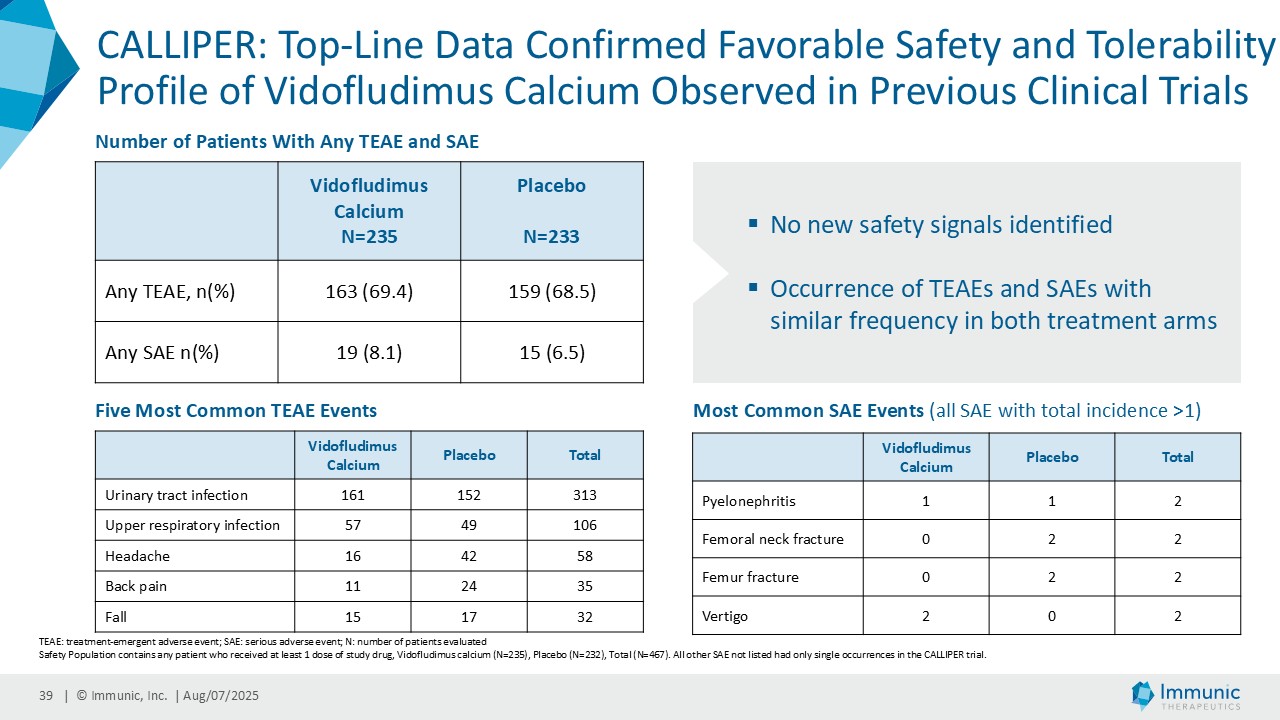
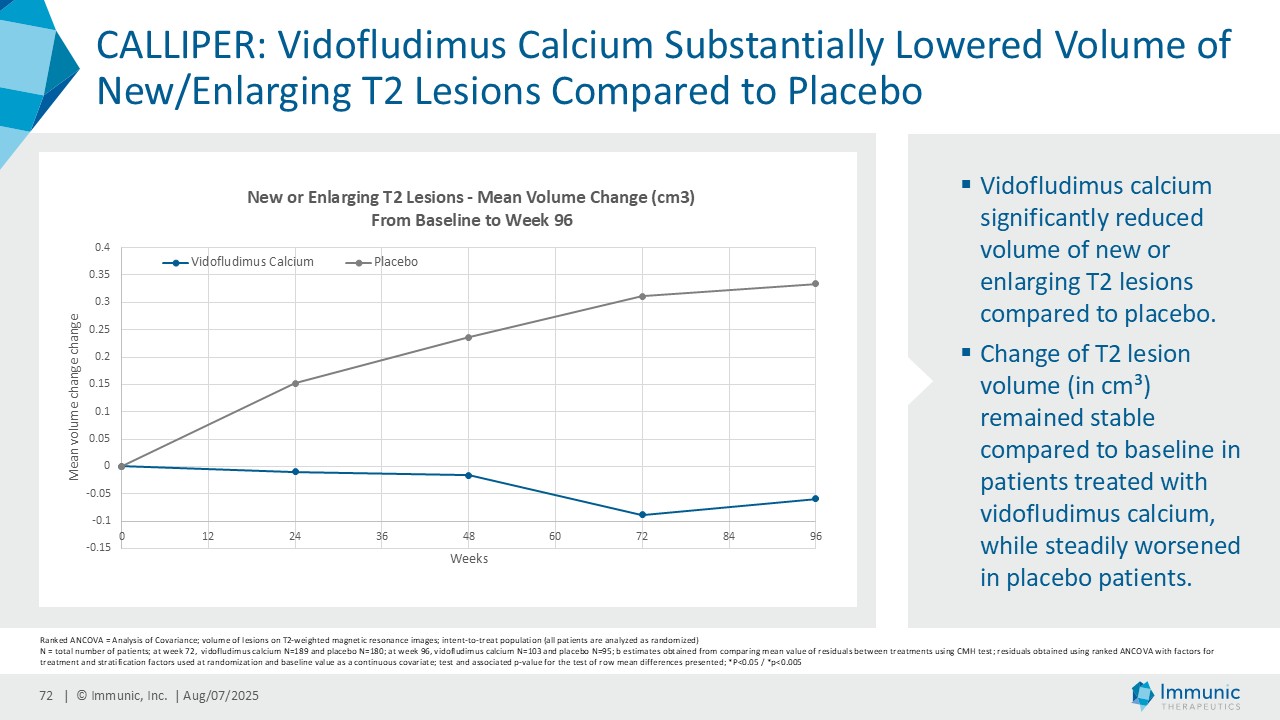
| · | 2025年4月PMS患者を対象としたビドフルジムス・カルシウムの第2相CALLIPER試験の良好なデータを発表。その結果、全試験集団およびPMSサブタイプにおいて、24wCDWイベントの相対リスクがプラセボと比較して減少したことが示された。特筆すべきは、ベースライン時に炎症性病変を認めない亜集団において、本薬は一貫して障害の悪化を抑制し、ベースライン時にガドリニウム増強病変を認めない患者において24wCDWを減少させたことである。ビドフルジムスカルシウムは、プラセボと比較して、視床の脳容積減少率および新規/拡大T2病変の容積を年率換算で大幅に減少させた。新たな安全性シグナルは確認されず、以前の臨床試験ですでに観察された良好な安全性および忍容性プロファイルが確認された。 |
| · | 2025年4月アバディーン・インベストメンツ主導による510万ドルの登録直接募集を発表。 |
| · | 2025年5月6,500万ドルの引受増資を発表。シリーズAワラントとシリーズBワラントが全額現金で行使された場合、最大で総額1億3,000万ドルの追加資金を受け取る可能性がある。この資金調達はBVF PartnersとCoastlands Capitalが共同で主導し、Aberdeen Investments、Adage Capital Partners LP、Janus Henderson Investors、その他の機関投資家も参加した。 |

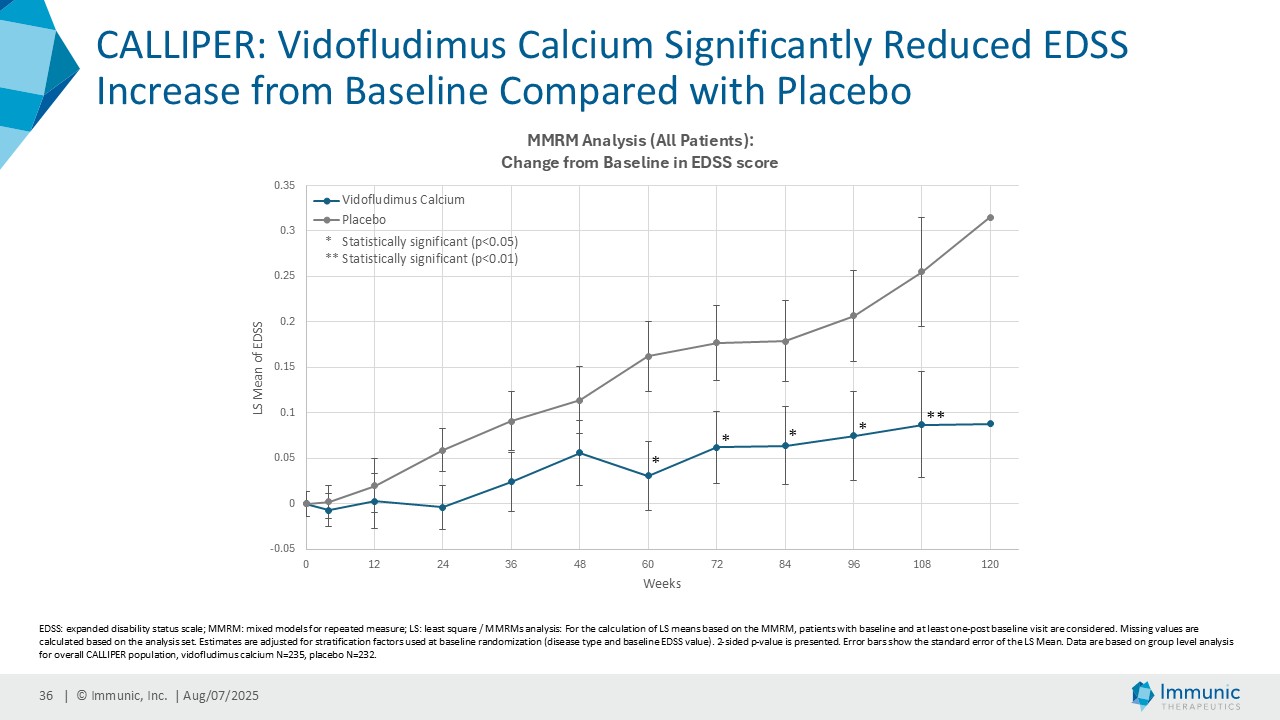
| · | 2025年6月ビドフルジムスカルシウムのPMS患者を対象とした第2相CALLIPER試験の良好な結果を裏付ける追加データを発表。副次評価項目である拡張障害状態尺度(EDSS)に基づく24wCDWまでの期間のデータは、ビドフルジムスカルシウムの神経保護能をさらに強化するものであった。同様に、トップライン・データと一致して、ベースライン時に炎症性ガドリニウム増強病変の活性がある場合とない場合の両方の亜集団のさらなる解析でも、有望な結果が示され続けた。 |
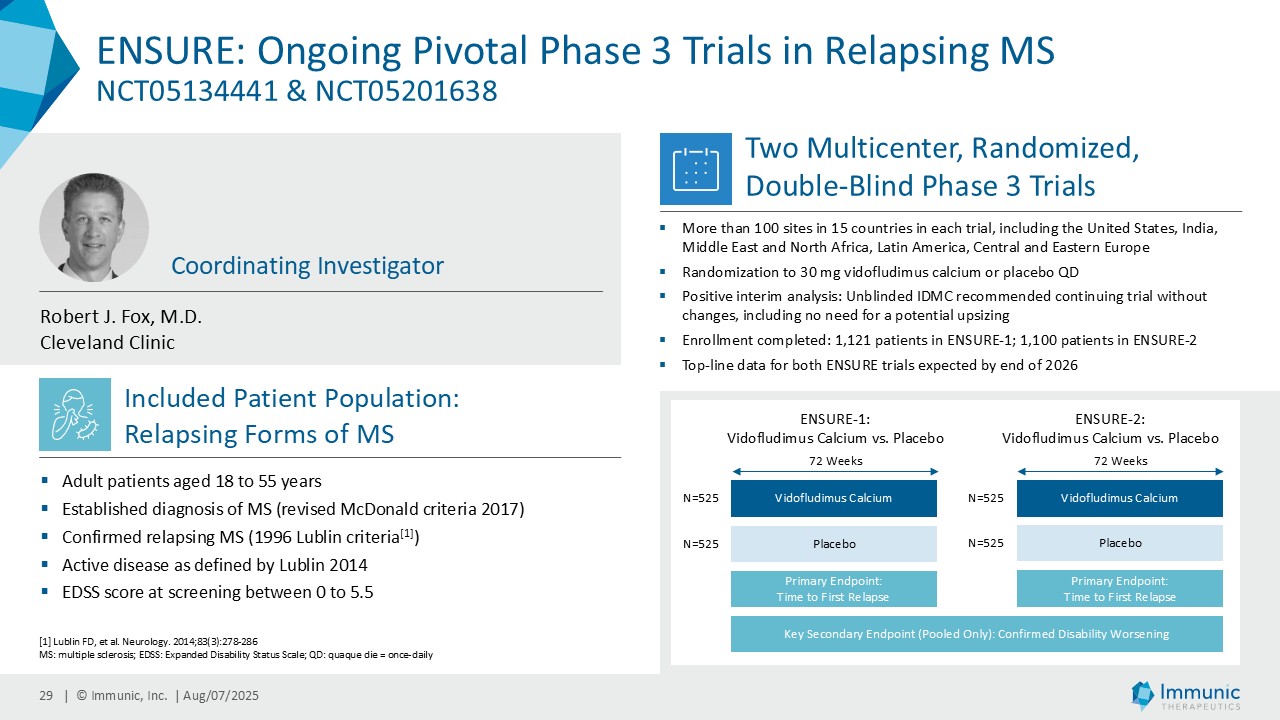
| · | 2025年6月RMS患者を対象としたビドフルジムスカルシウムの第3相ENSURE試験の両試験の登録が予定通り完了したことを発表。ENSURE-1では1,121人、ENSURE-2では1,100人の患者が、15カ国の100以上の施設で無作為化された。 |
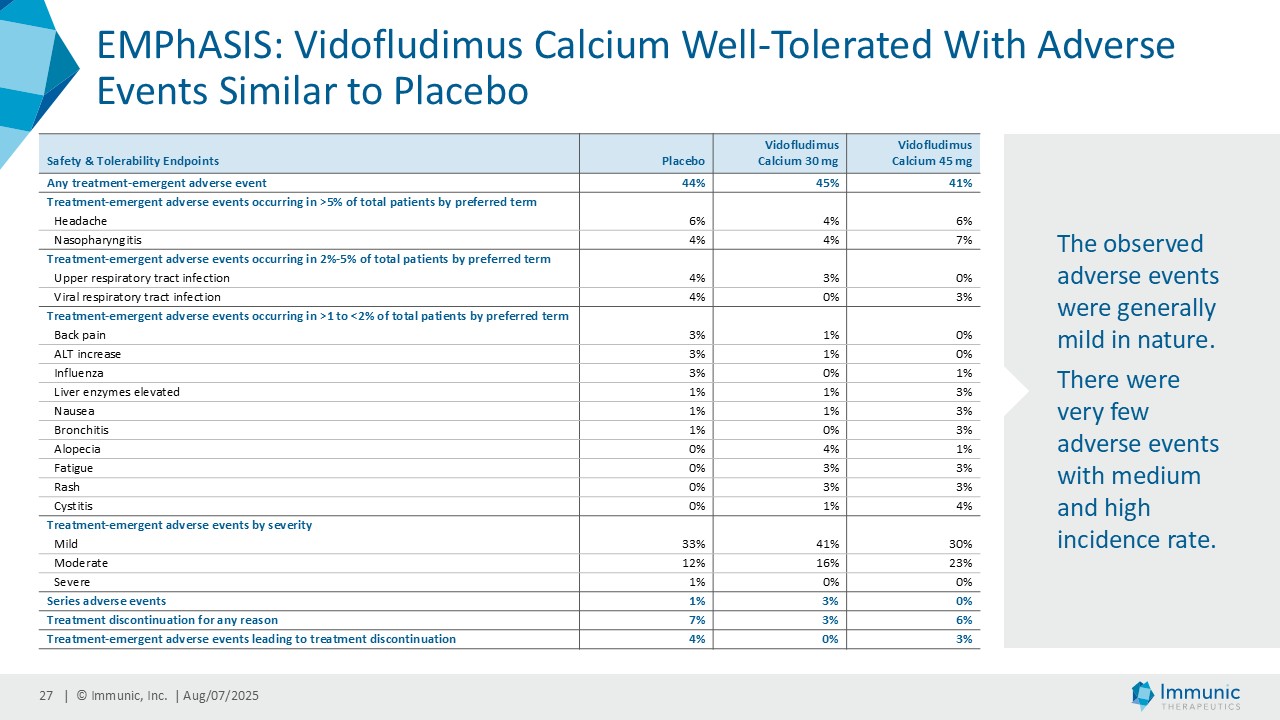
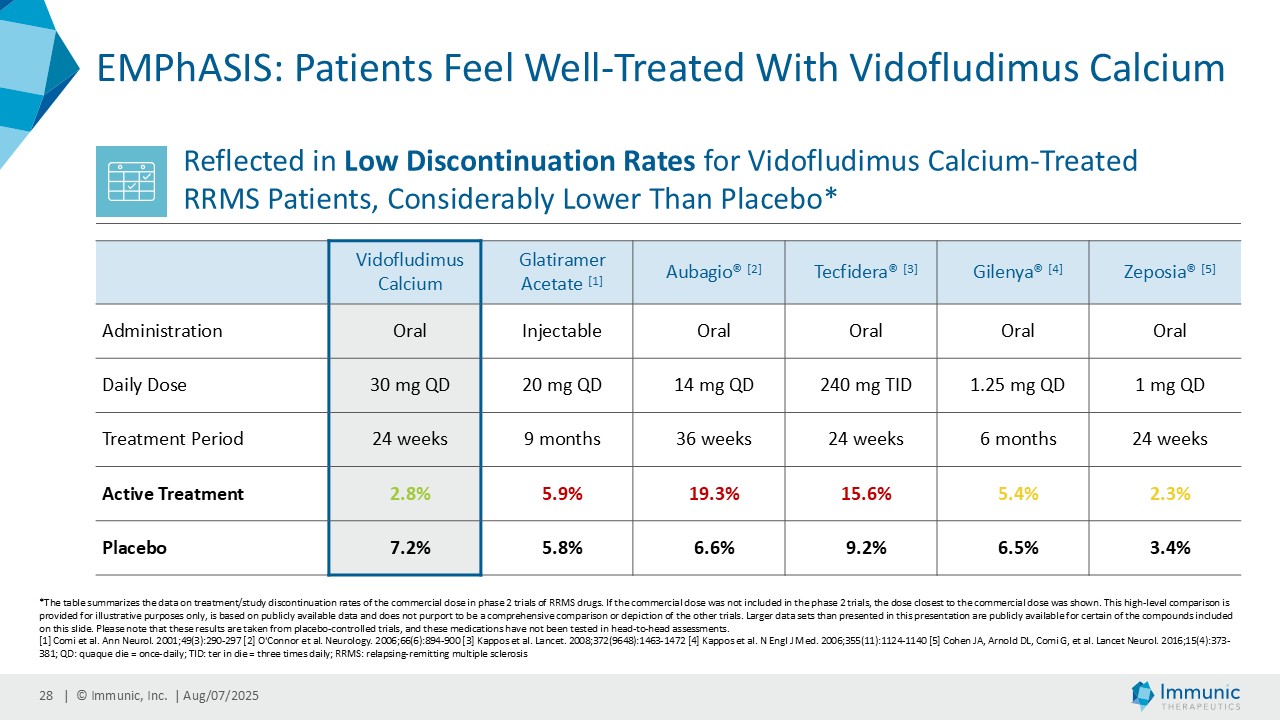
| · | 2025年6月RRMS患者を対象としたビドフルジムス・カルシウムの第2相EMPhASIS試験から、新たな長期OLEデータが報告された。144週目の時点で、92.3%の患者が12wCDWを、92.7%の患者が24wCDWを発症していない。ビドフルジムスカルシウムは、引き続き良好な安全性と忍容性プロファイルを示し、5.5年までの長期データが得られている。 |
Anticipated Clinical Milestones
| · | MSにおけるビドフルジムスカルシウム:双子の第3相ENSURE-1試験とENSURE-2試験のトップラインデータが2026年末までに期待される。 |
| · | IMU-856:同社は、資金調達、ライセンス供与、提携を条件として、IMU-856のさらなる臨床試験の準備を進めている。 |
財務および営業成績
2025年6月30日に終了した3カ月間の研究開発(R&D)費用は、2024年6月30日に終了した3カ月間の1,830万ドルに対し、2,140万ドルであった。この300万ドルの増加は、(i)ビドフルジムスカルシウムプログラムに関連する外部開発費の260万ドルの増加、(ii)人件費の060万ドルの増加を反映している。この増加は、多くのカテゴリーにわたる関連費用の0.2百万ドルの減少により相殺された。
2025年6月30日に終了した6ヵ月間の研究開発費は4,290万ドル(2024年6月30日に終了した6ヵ月間は3,710万ドル)であった。580万ドルの増加は、ビドフルジムスカルシウムプログラムに関連する外部開発費の730万ドルの増加を反映しています。この増加は、セリアック病患者を対象とした第1b相臨床試験が2024年に完了したことによるIMU-856に関連する外部開発費の150万ドルの減少で相殺された。
| · | 2025 年 6 月 30 日に終了した 3 ヶ月間の一般管理費(G&A)は 570 万ドル(2024 年 6 月 30 日に終了した同期間は 450 万ドル)であった。120万ドルの増加は、(i)人件費の0.8百万ドルの増加、(ii)法務・コンサルタント費用の0.4百万ドルの増加によるものである。 |
2025年6月30日に終了した6ヶ月間のG&A費は1,100万ドルであった(2024年6月30日に終了した同期間は960万ドル)。140万ドルの増加は、(i)人件費関連で0.7百万ドルの増加、(ii)法務およびコンサルタント費用で0.5百万ドルの増加、(iii)多数のカテゴリーにわたる関連費用で0.2百万ドルの増加によるものである。
| · | 2025年6月30日に終了した3ヵ月間の受取利息は0.2百万ドルで、2024年6月30日に終了した3ヵ月間は1.0百万ドルであった。0.8百万ドルの減少は、平均現金残高の減少によるものである。 |

2025年6月30日に終了した6ヵ月間の受取利息は0.4百万ドルであった(前年同期は2.2百万ドル)。180万ドルの減少は、平均現金残高の減少によるものである。
| · | 2024年6月30日に終了した6ヵ月間におけるトランシェ権利の公正価値の変動480万ドルは、2024年1月8日から2024年3月4日までの2024年1月の資金調達に関連するトランシェ権利の価値の変動に関連する現金支出を伴わない費用であった。これらのトランシェ権は当初、負債に分類されていたが、これは会社が公募増資のトランシェ2およびトランシェ3で発行する十分な発行可能株式数を保有していなかったためである。しかし、2024年3月4日に株主総会で授権株式数が1億3,000万株から5億株に増加することが承認されたため、これらのトランシェ2およびトランシェ3の権利は資本に再分類され、資本に再分類された時点で公正価値に再評価する必要があった。2025年6月30日に終了した第2四半期連結累計期間において、新株予約権の公正価値の変動は認識されていない。 |
| · | 2025年6月30日に終了した3ヵ月間のその他の収入(支出)は、前年同期の0.4百万ドルに対して0.2百万ドルであった。0.4百万ドルの減少は、主に多数のカテゴリーにわたる活動によるものである。 |
2025年6月30日に終了した6ヶ月間のその他収益(費用)は120万ドルで、2024年6月30日に終了した同期間は(170万ドル)であった。この280万ドルの増加は主に、(i)2024年1月の資金調達による取引費用のうち、2024年の取引完了時に設定されたトランシェ権に関連する部分に関する費用170万ドル、(ii)2025年第1四半期に認識されたドイツ連邦財務省の助成金収入100万ドル、および(iii)多数のカテゴリーにわたる0.1百万ドルの増加によるものである。
| · | 2025年6月30日に終了した3ヶ月間の純損失は約2,700万ドル(基本的および希薄化後1株当たり0.20ドル)であったのに対し、2024年6月30日に終了した同期の純損失は約2,140万ドル(基本的および希薄化後1株当たり0.21ドル)であった(加重平均発行済普通株式数132,175,202株ベース)。 |
2025年6月30日に終了した6ヶ月間の純損失は約5,230万ドル、基本的および希薄化後1株当たり0.45ドルで、これに対し2024年6月30日に終了した同期の純損失は約5,100万ドル、基本的および希薄化後1株当たり0.51ドル、加重平均発行済み普通株式数は1億1,684万4,985株であった。
| · | 2025年6月30日現在の現金および現金同等物は5,530万ドル。この現金では、追加資本を調達しない限り、2025年6月30日から少なくとも12ヶ月間の事業資金を賄うに十分な流動性を有していない。 |
About Immunic, Inc.
イミュニック・インク(Nasdaq: IMUX)は、慢性炎症性疾患および自己免疫疾患に対する経口低分子治療薬の臨床パイプラインを開発しているバイオテクノロジー企業である。同社の主要開発プログラムであるビドフルジムス・カルシウム(IMU-838)は現在、再発性多発性硬化症の治療薬として第3相臨床試験段階にあり、2026年末までにトップラインデータが得られる予定である。すでに、再発寛解型多発性硬化症および進行性多発性硬化症の患者を対象とした第2相臨床試験で治療効果を示している。ビドフルジムス・カルシウムは、ジヒドロオロチン酸デヒドロゲナーゼ(DHODH)という酵素を選択的に阻害することにより、ファースト・イン・クラスの核内受容体関連1(Nurr1)活性化因子としてのメカニズムによる神経保護作用と、さらなる抗炎症作用および抗ウイルス作用を併せ持つ。サーチュイン6(SIRT6)というタンパク質を標的とするIMU-856は、腸のバリア機能を回復させ、腸上皮を再生させることを目的としており、セリアック病や炎症性腸疾患、移植片対宿主病、体重管理など、多くの消化器疾患に応用できる可能性がある。現在前臨床試験段階にあるIMU-381は、特に消化器疾患のニーズに対応するために開発されている次世代分子である。詳細はwww.imux.com。

将来の見通しに関する記述についての注意事項
本プレスリリースには、1995年米国私募証券訴訟改革法が定めるセーフハーバーの目的上、重大なリスクと不確実性を伴う「将来の見通しに関する記述」が含まれています。本プレスリリースに含まれる、戦略、将来の事業運営、将来の財務状況、将来の収益、予測費用、現金および現金収支の十分性、予想される時期、臨床試験の開発および結果、見通し、計画、経営陣の目標に関する記述は、過去の事実に関する記述を除き、すべて将来の見通しに関する記述です。このような記述の例としては、イミュニックの開発プログラムおよび対象疾患に関する記述、イミュニックの開発プログラムが対象疾患を安全かつ効果的に治療できる可能性に関する記述、イミュニックの開発プログラムに関する前臨床および臨床データなどがありますが、これらに限定されるものではありません;進行性多発性硬化症におけるvidofludimus calciumの第3相臨床試験への進展の可能性、現在および将来の臨床試験および予想される臨床マイルストーンのタイミング、会社の性質、戦略および重点事項ならびにこれらに関する今後の更新情報、会社の製品候補の開発および商業的可能性。Immunicは、将来予想に関する記述で開示された計画を実際に達成したり、意図を実行したり、期待や予測を達成したりしない可能性があり、これらの将来予想に関する記述を過度に信頼すべきではありません。このような記述は経営陣の現在の予想に基づくものであり、重大なリスクと不確実性を伴います。インフレ率の上昇、関税およびマクロ経済動向、ウクライナ・ロシア紛争および中東紛争が計画中および進行中の臨床試験に及ぼす影響、将来の現金利用率および偶発的な将来債務や事業運営に必要な準備金を予測する能力に関連するリスクおよび不確実性、事業目標および事業要件を満たすための十分な財務およびその他の資源の利用可能性など(ただし必ずしもこれらに限定されない)、多くの要因の結果として、実際の結果および業績は、将来見通しに関する記述で予測されたものとは大きく異なる可能性があります、また、継続企業の前提条件として十分な資本を調達できるかどうか、前臨床試験および臨床試験の結果が将来の臨床試験結果を予測できない可能性があること、当社製品または製品候補の対象市場規模の変化、当社の知的財産による保護および市場独占性、医薬品開発および規制当局の承認プロセスに関するリスク、競合製品および技術革新の影響などです。これらのリスク、不確実性およびその他の要因の詳細なリストおよび説明は、2025年3月31日にSECに提出された2024年12月31日終了会計年度の年次報告書(フォーム10-K)およびその後のSECへの提出書類の「リスク要因」の項に記載されています。これらの提出書類のコピーは、www.sec.gov または ir.imux.com/sec-filings からオンラインで入手できます。本リリースに記載されている将来の見通しに関する記述は、本リリースの日付時点のものです。Immunicは、これらの将来の見通しに関する記述が作成された日以降に存在する事象や状況を反映するために、これらの将来の見通しに関する記述を更新する意図や義務を一切否認します。イムニックは、本プレスリリースの内容の一部または全部に基づいてなされた、あるいはなされなかった行動に関する一切の責任を明示的に否認します。

Contact Information
イミュニック・インクJessica Breu 投資家対応・広報担当副社長 +49 89 2080 477 09 jessica.breu@imux.com
米国 IR 連絡先 Rx Communications Group Paula Schwartz +1 917 633 7790 immunic@rxir.com
米国メディア連絡先 KCSA Strategic Communications ケイトリン・カスニッチ +1 212 896 1241 ckasunich@kcsa.com
Financials

Immunic, Inc.
凝縮された連結損益計算書
(単位:千米ドル(1株当たりおよび1株当たりの金額を除く)
(Unaudited)
|
Three Months Ended June 30, |
会社開示情報をすべてご 会社開示情報をすべてご覧になる |
|||||||||||||||
| 2025 | 2024 | 2025 | 2024 | |||||||||||||
| 営業費用: | ||||||||||||||||
| 研究開発費 | $ | 21,369 | $ | 18,323 | $ | 42,902 | $ | 37,059 | ||||||||
| 一般管理費 | 5,714 | 4,491 | 11,006 | 9,636 | ||||||||||||
| 営業費用合計 | 27,083 | 22,814 | 53,908 | 46,695 | ||||||||||||
| 営業活動による損失 | (27,083 | ) | (22,814 | ) | (53,908 | ) | (46,695 | ) | ||||||||
| その他の収益(費用): | ||||||||||||||||
| 受取利息 | 241 | 998 | 424 | 2,185 | ||||||||||||
| トランシェ権の公正価値の変動 | — | — | — | (4,796 | ) | |||||||||||
| その他の収益(費用)(純額 | 22 | 436 | 1,191 | (1,658 | ) | |||||||||||
| Total other income (expense) | 263 | 1,434 | 1,615 | (4,269 | ) | |||||||||||
| 純損失 | $ | (26,820 | ) | $ | (21,380 | ) | $ | (52,293 | ) | $ | (50,964 | ) | ||||
| 基本的および希薄化後の1株当たり純損失 | $ | (0.20 | ) | $ | (0.21 | ) | $ | (0.45 | ) | $ | (0.51 | ) | ||||
| 加重平均発行済普通株式数、基本および希薄化後 | 132,175,202 | 101,272,580 | 116,844,985 | 99,607,158 | ||||||||||||

会社開示情報をすべてご覧にな
会社開示情報をすべて
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要
(Unaudited)






























 株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン
株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン