UNITED STATES
SECURITIES AND EXCHANGE COMMISSION
Washington, D.C. 20549
FORM 8-K
現行レポート
1934年米国証券取引所法第13条または第15条(d)に基づき
報告日(最も古いイベントの報告日):2024年2月22日
IMMUNIC社
(チャーターで指定された登録者の正確な名前)
| デラウェア | 001-36201 | 56-2358443 |
| (法人設立の州またはその他の管轄区域) | (Commission File Number) | (IRS Employer Identification No.) |
1200アベニュー・オブ・ジ・アメリカズ、スイート200
New York, NY 10036
USA
(主要経営陣の住所)
登録者の電話番号(市外局番を含む(332) 255-9818
Form8-Kの提出が、以下の条項のいずれかに基づく登録者の提出義務を同時に満たすことを意図している場合は、以下の該当するチェックボックスをチェックしてください:
| ☐ | 証券法に基づく規則425に従った書面によるコミュニケーション(17 cfr 230.425) |
| ☐ | 取引所法の下でのルール14a-12(17 cfr 240.14a-12)に基づく資料の勧誘。) |
| ☐ | 取引所法の規則14d-2(b)に基づく開始前のコミュニケーション(17 cfr 240.14d-2(b)) |
| ☐ | 証券取引法の規則13e-4(c)に基づく開始前のコミュニケーション(17 cfr 240.13e-4(c)) |
法第12条(b)に従って登録された証券:
| Title of each class | Trading Symbol(s) | 登録されている取引所の名称 |
| 普通株式、額面0.0001ドル | IMUX | the nasdaq stock market llc |
登録者が1933年証券法規則405(本章§230.405)または1934年証券取引法規則12b-2(本章§240.12b2)で定義される新興成長企業であるかどうかをチェックマークで示す。
Emerging growth company ☐
新興成長企業の場合、登録者が、取引所法第13条(a)に従って提供される新規または改訂された財務会計基準に準拠するための移行期間の延長を利用しないことを選択した場合は、チェックマークで示す。はい ☐ いいえ
Item 2.02. 営業成績および財務状況
2024年2月22日、Immunic, Inc.(以下「当社」)は、2023年12月31日に終了した四半期および年度の業績を発表し、企業最新情報を提供するプレスリリース(その写しを別紙99.1として添付)を発表した(以下「プレスリリース」)。
プレス・リリースを含め、本フォーム 8-K の項目 2.02 に記載された情報は、1934 年証券取引所法(改正後)第 18 条における「提出された」ものとはみなされず、同法または 1933 年証券取引所法(改正後)第 11 条および第 12 条(a)(2)の責任を問われるものではありません。また、本情報は、米国証券取引委員会に提出する当社のいかなる提出書類にも、当該提出書類に明示的に言及されている場合を除き、参照により組み込まれるものとはみなされません。
Item 8.01. Other Events
2024年2月22日、当社は最新のプレゼンテーションをウェブサイトに掲載した。同プレゼンテーションのコピーは別紙99.2としてここに提出され、参照することによりここに組み込まれる。
Item 9.01. 財務諸表および添付資料
| Exhibit | Description | |
| 99.1 | 2024年2月22日付プレスリリース | |
| 99.2 | 2024年2月22日付プレゼンテーション | |
| 104 | inline xbrlでのこのcurrent report on form 8-kのカバーページ |
SIGNATURES
1934年証券取引所法(改正後)の要件に従い、登録者は本報告書に正式に権限を付与された署名者により、登録者を代表して署名させた。
| Dated: February 22, 2024 | Immunic, Inc. | |
| By: | /s/ Daniel Vitt | |
| Daniel Vitt | ||
| Chief Executive Officer | ||

イミュニック・インク2023年12月期決算報告と最新情報のお知らせ
- 2024年1月に最大2億4,000万ドルの3回にわたる第三者割当増資を実施し、バランスシートを大幅に強化。
– ビドフルジムス・カルシウムの神経保護活性を示唆する臨床第2相CALLIPER試験の中間解析結果、進行性多発性硬化症患者全体および全サブタイプで一貫したエビデンス、CALLIPER試験のトップラインデータは2025年4月に得られる見込み-|ニュースリリース|大日本住友製薬
– 再発性多発性硬化症を対象とした臨床第3相ENSUREプログラムが進行中 - (英文)
– ビドフルジムス・カルシウムの特許ポートフォリオを拡大し、新たな特許を追加取得。
– ウェブキャストは本日2024年2月22日午前8時(米国東部時間)より開催される。
ニューヨーク、2024年2月22日-慢性炎症性疾患および自己免疫疾患に対する経口低分子治療薬の臨床パイプラインを開発中のバイオテクノロジー企業であるイムニック・インク(Nasdaq: IMUX)は本日、2023年12月31日を期末とする第4四半期および通期の決算を発表し、企業最新情報を提供しました。
「イムニックは2023年を通して目覚ましい進歩を遂げ、先月発表した最大2億4,000万ドルの3回にわたる第三者割当増資に成功しました。イミュニックの最高経営責任者兼社長ダニエル・ヴィット博士は、「イミュニックは、2023年を通して目覚ましい発展を遂げ、その成果は、今月発表した最大2億4000万ドルの3回にわたる第三者割当増資の成功に結実しました。
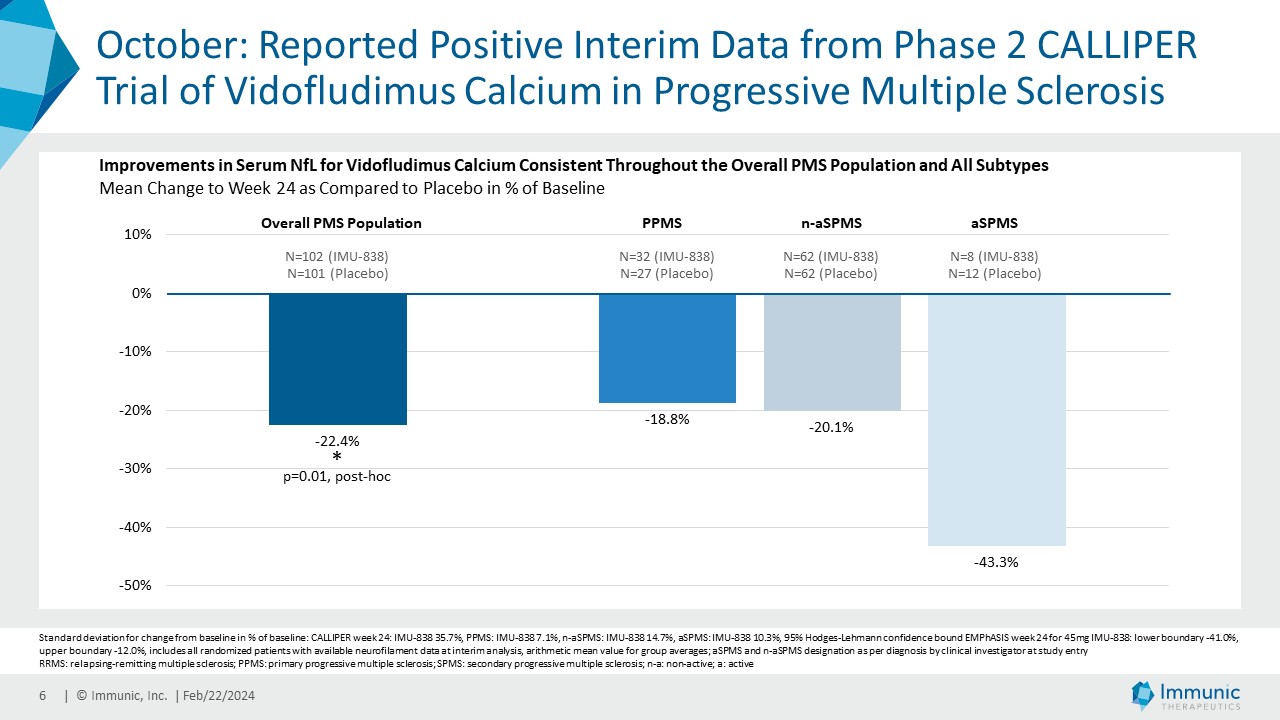
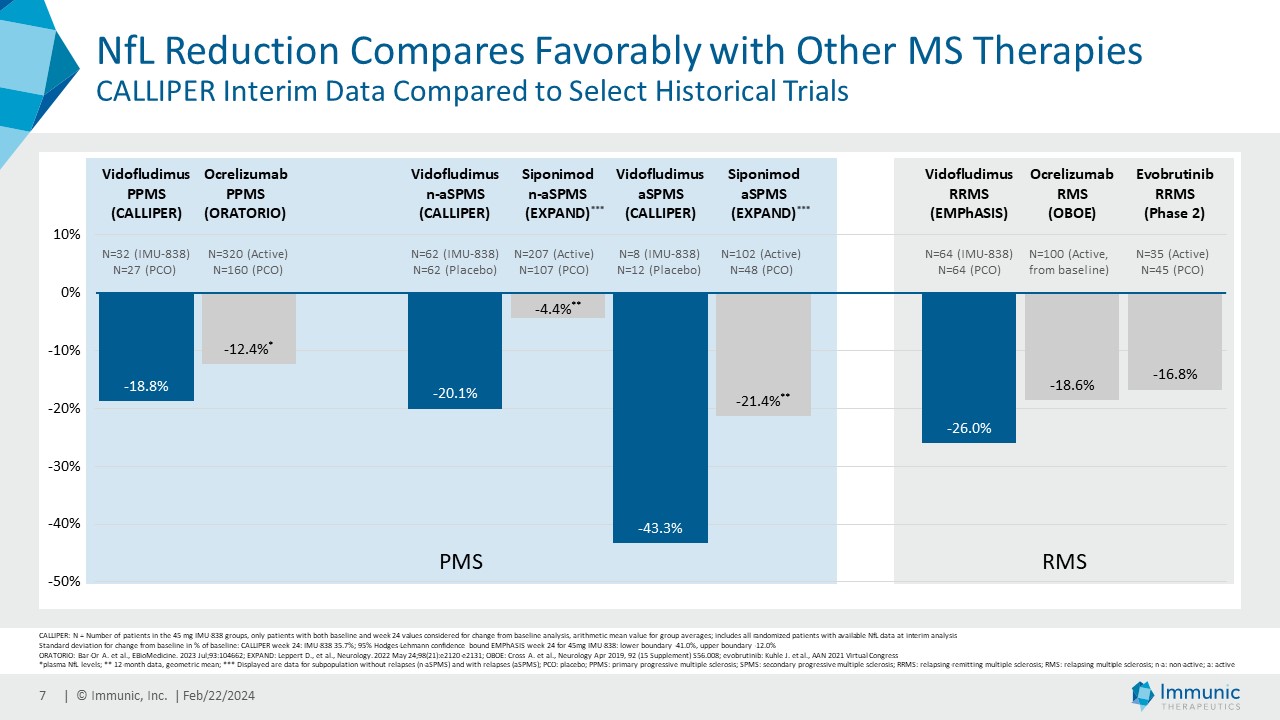
「第 4 四半期には、当社のリードアセットである核内受容体関連 1(Nurr1)活性化剤ビ ドフルジムス・カルシウムの第 2 相 CALLIPER 試験の中間バイオマーカー解析を報告しました。非常に有望な結果は、進行性多発性硬化症(PMS)患者において、血清ニューロフィラメント軽鎖(NfL)レベルがプラセボから明らかに分離したことを実証した。この効果は、進行した二次性進行性多発性硬化症(SPMS)を含むすべての亜集団で認められ、多発性硬化症(MS)におけるアンメットニーズが非常に高い分野であると私たちは考えています。さらに、2025年4月に予定されているCALLIPERのトップラインデータで神経保護作用が引き続き示されれば、ビドフルジムス・カルシウムを進行型SPMSに対する最初の経口治療薬として位置づけることができるかもしれません。この待望のデータは、最近実施した資金調達の第一弾8000万ドルによって全額賄われ、資金調達枠は2025年第3四半期まで延長されます。第3相ENSUREプログラムの中間有用性解析は今年後半に予定されており、ENSURE試験の最初の結果は2026年第2四半期に発表される予定です。承認されれば、ビドフルジムス・カルシウムは、神経保護作用、抗炎症作用、抗ウイルス作用を併せ持つことから、MSの複雑な病態生理をターゲットとしたユニークな治療選択肢となる可能性があると考えます。ビドフルジムスおよびその塩と遊離酸の形態に関する特許保護が何重にも積み重ねられていることに注目することは重要である。11月には、再発性多発性硬化症(RMS)治療の臨床試験で使用された特定の投与強度とMS治療に関連する投与レジメンをカバーする2つの基本的な新規特許を米国で取得しました。その結果、当社の広範な特許ポートフォリオは、さらに延長されない限り、米国において2041年まで保護されることになります。"

第4四半期には、セリアック病患者を対象とした、SIRT6(サーチュイン6)を標的とする経口投与可能な全身作用型低分子モジュレーターであるIMU-856の臨床第1b相試験の良好な結果を2つの権威ある医学学会で発表しました。その結果、セリアック病の病態生理の4つの重要な側面(組織学、疾患症状、バイオマーカー、栄養吸収)において、プラセボと比較して有意な改善が示されました。このデータは、今日、多くの消化器疾患で用いられている伝統的な免疫調節アプローチではなく、腸管構造の再生を通じて、多くの消化器疾患に対する新しい経口治療アプローチの可能性を示す、最初の臨床的概念実証になると考えています。現在、進行中の活動性セリアック病(OACD)を対象とした第2相試験の準備を進めており、その他の消化器疾患への臨床応用も検討しています。"
2023年第4四半期以降のハイライト
| · | 2024年1月リード・インベスターのBVF Partnersをはじめ、Avidity Partners、Janus Henderson Investors、Soleus Capital、RTW Investments、Adage Capital Partnersなど、厳選された新規および既存投資家が参加し、最大2億4,000万ドルの3トランシェ第三者割当増資を発表。2024年1月8日にクローズした第1弾では、総額8,000万ドルの総収入を得た。 |
| · | 2023年11月米国特許商標庁(USPTO)より、ビドフルジムス・カルシウムおよびその他の塩、遊離酸のMS治療薬に関する特許出願17/992,162(MS臨床プログラムで試験されたすべてのレジメンを含む)の許可通知を受領。 |
| · | 2023年11月特許出願17/391,442は、ビドフルジムス・カルシウムの1日投与量約10mg~45mg、および現在進行中の双対第3相ENSURE試験で使用されている30mgの投与量を含む他の塩および遊離酸の形態を対象とし、RMSの治療に使用される。特許請求の範囲は、さらに延長されない限り、2041年まで保護される見込みである。 |
| · | 2023年11月欧州セリアック病学会(AOECS)第35回総会において、セリアック病患者を対象としたIMU-856の第1b相臨床試験データをポスター発表。 |
| · | 2023年10月欧州消化器病学会(UEGW)2023において、セリアック病患者を対象としたIMU-856の第1b相臨床試験のデータをポスターセッションで発表。また、中等度から重度の潰瘍性大腸炎(UC)を対象としたビドフルジムス・カルシウムの第2相臨床試験CALDOSE-1のデータを口頭発表。 |
| · | 2023年10月MSMilan2023にて、再発寛解型MSを対象としたビドフルジムス・カルシウムの第2相EMPhASIS試験のデータをePosterで発表:第9回ECTRIMS-ACTRIMS合同会議。 |
| · | 2023年10月PMSを対象としたビドフルジムス・カルシウムの第2相CALLIPER試験の良好な中間データを報告。ビ ドフルジムスカルシウムの血清NfLの改善は、PMSおよびすべての疾患サブタイプにおいて、また疾患および/または磁気共鳴画像法(MRI)の活性を示す患者、示さない患者において一貫して観察された。このデータは、ビドフルジムス・カルシウムの活性が、これまでに観察された抗炎症作用を超えていることを示すバイオマーカーの証拠であり、神経保護作用の可能性をさらに補強するものであるとイムニックは考えている。本試験の登録は8月に完了した。総計467人の原発性PMS、または活動性もしくは非活動性のSPMS患者が、ビドフルジムスカルシウム45mgまたはプラセボのいずれかに無作為に割り付けられた。 |

Anticipated Clinical Milestones
| · | MSにおけるビドフルジムスカルシウム:PMSにおけるビドフルジムスカルシウムの第2相CALLIPER試験のトップラインデータは2025年4月に期待される。ENSUREプログラムの中間解析は2024年後半に予定されている。ENSURE試験の最初のリードアウトは2026年第2四半期、ENSURE試験の2番目は2026年後半と予想されている。 |
| · | セリアック病におけるIMU-856:第1b相臨床試験の良好なデータに基づき、同社はグルテンフリー食にもかかわらずOACDを発症した患者を対象としたIMU-856の第2相臨床試験の準備を進めている。 |
財務および営業成績
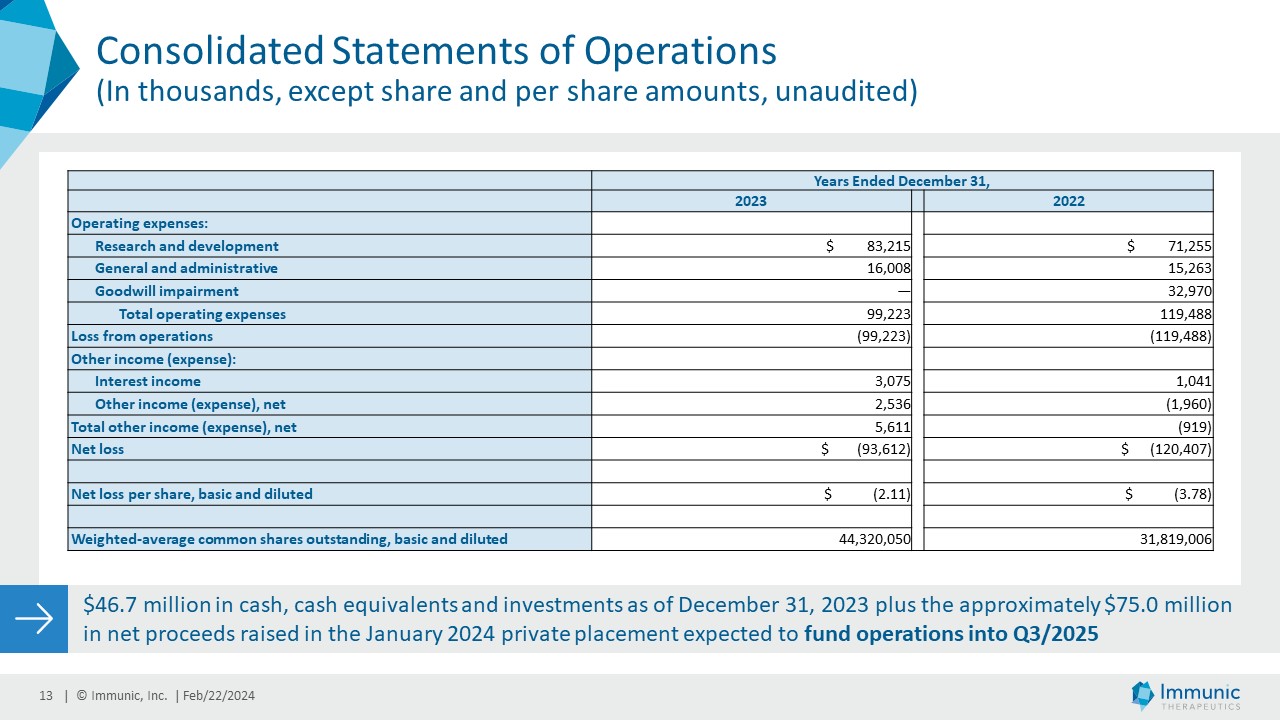
| · | 研究開発費(R&D)は、2022年12月31日に終了した12カ月間の7,120万ドルに対し、2023年12月31日に終了した12カ月間は8,320万ドルでした。この1,220万ドルの増加は、(i)RMSおよびPMSを対象としたビドフルジムス・カルシウムの進行中の臨床プログラム、進行中のIMU-856臨床プログラム、および進行中の試験をサポートするためのビドフルジムス・カルシウムの薬剤供給費の増加に関連する外部開発費の1,910万ドルの増加、および(ii)人員の増加に関連する研究開発における人件費の220万ドルの増加(うち0.2百万ドルは現金支出を伴わない株式ベースの報酬によるもの)を反映しています。この増加は、(i)乾癬および去勢抵抗性前立腺がんを対象としたイズメロガント・プログラムの優先順位を下げたことによる650万ドルの減少、(ii)潰瘍性大腸炎を対象としたビドフルジムス・カルシウムの第2相臨床試験に関連する外部開発費の250万ドルの減少、(iii)多くのカテゴリーにわたる関連費用の330万ドルの増加により一部相殺された。 |
| · | 2023年12月31日に終了した12ヶ月間の一般管理費(G&A)は1,600万ドルで、2022年12月31日に終了した同期間は1,530万ドルであった。0.7百万ドルの増加は主に、(i)法律顧問費、旅費、施設費が0.9百万ドル増加したこと、および(ii)多数のカテゴリーにわたって0.3百万ドル増加したことによるものである。この増加は、主に現金支出を伴わない株式報酬の減少による一般管理部門の人件費の0.5百万ドルの減少により一部相殺された。 |
| · | 2023年12月31日に終了した12ヶ月間のその他の収益(費用)は、2022年12月31日に終了した同期間の(0.9百万ドル)に対して5.6百万ドルであった。650万ドルの増加は主に、(i)為替差損が390万ドル減少したこと、(ii)ドイツ連邦財務省から2021年および2022年の税務年度に帰属する研究引当金が230万ドル計上されたこと、および(iii)金利上昇により受取利息が200万ドル増加したことに起因する。この増加は、(i)オーストラリアにおける臨床試験への支出が減少した結果、オーストラリアにおける臨床試験に対する研究開発税制優遇措置が160万ドル減少したこと、および(ii)多数のカテゴリーにわたって0.1百万ドル減少したことにより一部相殺された。 |
| · | 2023年12月31日に終了した12ヶ月間の純損失は約9,360万ドル、基本的および希薄化後1株当たり2.11ドルで、これに対し2022年12月31日に終了した同期の純損失は約1億2,040万ドル、基本的および希薄化後1株当たり3.78ドル、加重平均発行済み普通株式数44,320,050株ベースであった。 |
| · | 2023年12月31日現在の現金、現金同等物および投資は4,670万ドルであった。これらの資金と、2024年1月の第三者割当増資の第1弾で調達した約7,500万ドルの正味収入により、イミュニックは2025年第3四半期までの事業資金を確保できる見込みである。 |

Webcast Information
イミュニックは本日午前8時(米国東部時間)よりウェブキャストを行います。ウェブキャストへの参加をご希望の方は、https://imux.zoom.us/webinar/register/WN_NCQiFCMpTJ2WEqAc2FnB3A、またはイミュニックのウェブサイトir.imux.com/events-and-presentationsの「Events and Presentations」から事前にご登録ください。登録者には、オンライン参加用のリンクまたはダイヤルイン用の電話番号が記載された確認メールが送信されます。
ウェブキャストのアーカイブ再生は、終了後約1時間後にイミュニックのウェブサイト(ir.imux.com/events-and-presentations)にてご覧いただけます。
About Immunic, Inc.
イミュニック・インク(Nasdaq: IMUX)は、慢性炎症性疾患および自己免疫疾患に対する経口低分子治療薬の臨床パイプラインを開発しているバイオテクノロジー企業である。同社の主要開発プログラムであるビドフルジムス・カルシウム(IMU-838)は、現在、再発性多発性硬化症および進行性多発性硬化症の治療薬としてそれぞれ第3相および第2相臨床試験段階にあり、再発性多発性硬化症、進行性多発性硬化症および中等度から重度の潰瘍性大腸炎を患う患者を対象とした第2相臨床試験で治療活性を示した。ビドフルジムス・カルシウムは、ジヒドロオロチン酸デヒドロゲナーゼ(DHODH)を選択的に阻害することにより、ファースト・イン・クラスの核内受容体関連1(Nurr1)活性化因子としてのメカニズムによる神経保護作用と、さらなる抗炎症作用および抗ウイルス作用を併せ持つ。サーチュイン6(SIRT6)を標的とするIMU-856は、腸のバリア機能を回復させ、腸上皮を再生させることを目的としており、セリアック病など多くの消化器疾患に応用できる可能性があり、現在第2相臨床試験の準備中である。現在前臨床試験中のIMU-381は、消化器疾患のニーズに特化して開発中の次世代分子である。詳細については、www.imux.com。

将来の見通しに関する記述についての注意事項
本プレスリリースには、1995年米国私募証券訴訟改革法が定めるセーフハーバーの目的上、重大なリスクと不確実性を伴う「将来の見通しに関する記述」が含まれています。本プレスリリースに含まれる、戦略、将来の事業運営、将来の財務状況、将来の収益、予測費用、現金および現金収支の十分性、予想される時期、臨床試験の開発および結果、見通し、計画、経営陣の目標に関する記述は、過去の事実に関する記述を除き、すべて将来の見通しに関する記述です。このような記述の例としては、イミュニックの開発プログラムおよび対象疾患に関する記述、イミュニックの開発プログラムが対象疾患を安全かつ効果的に治療できる可能性に関する記述、イミュニックの開発プログラムに関する前臨床および臨床データ、現在および将来の臨床試験の実施時期および予想される臨床マイルストーン、イミュニックの性質、戦略、重点事項およびこれらに関する今後の更新情報、イミュニックの製品候補の開発および商業的可能性に関する記述、イミュニックの予想されるキャッシュ・ランウェイが含まれますが、これらに限定されるものではありません。Immunicは、将来予想に関する記述で開示された計画を実際に達成したり、意図を実行したり、期待や予測を達成したりしない可能性があり、これらの将来予想に関する記述を過度に信頼すべきではありません。このような記述は経営陣の現在の予想に基づくものであり、重大なリスクと不確実性を伴います。COVID-19の流行、インフレの進行、ウクライナとロシアの紛争および中東の紛争が計画中および進行中の臨床試験に及ぼす影響、将来の現金利用を予測する能力に関連するリスクおよび不確実性、将来の偶発債務および事業運営に必要な準備金など(ただし必ずしもこれらに限定されない)、多くの要因の結果として、実際の結果および業績は、将来見通しに関する記述で予測されたものとは大きく異なる可能性があります、事業目的および事業要件を満たすための十分な財務およびその他の資源の利用可能性、初期の前臨床試験および臨床試験の結果が将来の臨床試験結果を予測できない可能性があること、Immunic社の知的財産による保護および市場独占性、医薬品開発および薬事承認プロセスに関するリスク、競合製品および技術変化の影響。これらのリスク、不確実性およびその他の要因の詳細なリストおよび説明は、2024年2月22日に米国証券取引委員会に提出された2023年12月31日終了会計年度の年次報告書(フォーム10-K)およびその後の米国証券取引委員会への提出書類の「リスク要因」の項に記載されています。これらの提出書類のコピーは、www.sec.gov または ir.imux.com/sec-filings からオンラインで入手できます。本リリースに記載されている将来の見通しに関する記述は、本リリースの日付時点のものです。Immunicは、これらの将来見通しに関する記述が作成された日以降に存在する事象や状況を反映するために、これらの将来見通しに関する記述を更新する意図や義務を一切否認します。イムニックは、本プレスリリースの一部または全部の内容に基づいてなされた、あるいはなされなかった行動に関する一切の責任を明示的に否認します。
Contact Information
イミュニック・インクJessica Breu 投資家対応・広報担当副社長 +49 89 2080 477 09 jessica.breu@imux.com
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧

会社開示情報をすべてご
会社開示情報をすべてご覧にな
会社開示情報をすべてご
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要
(Unaudited)

会社開示情報をすべてご覧になる
会社開示情報をすべてご覧になるには株探プレミアムの登録が
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要
(Unaudited)















 株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン
株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン