UNITED STATES
SECURITIES AND EXCHANGE COMMISSION
WASHINGTON, D.C. 20549
FORM 8-K
現行レポート
セクション13または15に基づいて(d)
1934年の証券取引所法の
報告日(最も古いイベントの報告日):2024年1月8日
Atara Biotherapeutics, Inc.
(チャーターで指定された登録者の正確な名前)
| デラウェア | 001-36548 | 46-0920988 | ||
| (会社設立の州またはその他の管轄区域) | (Commission File Number) |
(IRS EmployerIdentification No.) | ||
| 2380 Conejo Spectrum Street Suite 200 |
||||
| Thousand Oaks, California | 91320 | |||
| (主要経営陣の住所) | (Zip Code) | |||
登録者の電話番号(市外局番を含む)。(805) 623-4211
(前回の報告書以降に変更があった場合、旧姓または旧住所)
Form8-Kの提出が、以下の条項のいずれかに基づく登録者の提出義務を同時に満たすことを意図している場合は、以下の該当するチェックボックスをチェックしてください:
| ☐ | 証券法に基づく規則425に従った書面によるコミュニケーション(17 cfr 230.425) |
| ☐ | 取引所法の下でのルール14a-12(17 cfr 240.14a-12)に基づく資料の勧誘。) |
| ☐ | 取引所法の規則14d-2(b)に基づく開始前のコミュニケーション(17 cfr 240.14d-2(b)) |
| ☐ | 証券取引法の規則13e-4(c)に基づく開始前のコミュニケーション(17 cfr 240.13e-4(c)) |
法第12条(b)項に基づいて登録された証券:
| Title of each class |
TradingSymbol(s) |
Name of each exchange on which registered |
||
| 普通株式、額面は1株あたり0.0001ドル | ATRA | the nasdaq stock market llc |
登録者が1933年証券法規則405(本章§230.405)または1934年証券取引法規則12b-2(本章§240.12b-2)で定義される新興成長企業であるかどうかをチェックマークで示す。
Emerging growth company ☐
新興成長企業の場合、登録者が取引所法第13条(a)に従い提供される新規または改訂された財務会計基準に準拠するための移行期間の延長を利用しないことを選択した場合は、チェックマークで示す。☐
| Item 2.05 | 撤退または処分活動に関連する費用。 |
2024年1月8日、アタラ・バイオセラピューティクス社(以下「当社」)は、現従業員の約25%に影響する人員削減を発表した。当社は2024年5月までに人員削減を実質的に完了する予定である。
人員削減により解雇された従業員に対する退職金および関連手当として、総額約450万ドルを計上する見込みである。これらの費用は主に1回限りの解雇手当であり、主に現金支出である。また、人員削減の結果、あるいは人員削減に関連して発生する可能性のある事象により、現在予定されていないその他の費用や現金支出が発生する可能性もある。
詳細については、2024年3月31日を期末とする四半期報告書(Form 10-Q)に記載される。
| Item 5.02 | 取締役または特定の役員の退任、取締役の選任、特定の役員の選任、特定の役員の報酬の取り決め。 |
2024年1月8日、当社は、当社のエグゼクティブ・バイスプレジデント兼チーフ・メディカル・オフィサーであるマンヘル(AJ)・ジョシ氏の雇用を2024年2月2日をもって終了することを発表した。ジョシ博士と当社との間で締結された2020年11月10日付の役員雇用契約の条項に従い、ジョシ博士は12カ月分の基本給継続分の退職手当を受け取る権利を有し、また、本人が適時に保険適用を選択することを条件として、当社は最大12カ月分の医療給付継続分を支払う。
ジョシ博士の退社に関連し、ジョシ博士が当社を支持する一般免責を締結することを条件として、当社はジョシ博士とコンサルティング契約を締結する予定であり、これに基づきジョシ博士は2025年1月31日まで当社にコンサルティング・サービスを提供する。ジョシ博士には、毎月指定されたコンサルティング時間数まで月額3,000ドルのコンサルティング料が支払われ、当該指定されたコンサルティング時間数を超過した場合には、1時間あたり200ドルの追加報酬が支払われる予定である。ジョシ博士の未使用の譲渡制限付株式ユニットの株式報酬は、コンサルティング期間中も権利が確定する。さらにジョシ博士は、タベレキュセルの生物製剤承認申請が米国食品医薬品局(FDA)により承認された場合、185,000ドルを受け取る権利を有する。
| Item 7.01 | Regulation FD Disclosure. |
当社は、2024年1月8日から開催される第42回J.P.モルガン・ヘルスケア・カンファレンスに関連して、証券アナリストや投資家などとのミーティングを実施する予定です。これらのミーティングの一環として、当社は本Current Report on Form 8-Kに添付されたスライド資料99.1を利用する予定です。
本項目7.01に記載された情報(本書添付の別紙99.1を含む)は、レギュレーションFDに従って提出されたものであり、提出されたものではありません。従って、本Form 8-Kの項目7.01および添付資料99.1に記載された情報は、参照によりそこに組み込まれることが明記されていない限り、1933年証券法に基づいて当社が提出した登録届出書に参照により組み込まれることはありません。本Form 8-Kに記載された情報の提供は、本Form 8-Kに記載された情報が重要または完全であること、あるいは投資家が当社の有価証券に関して投資判断を下す前に本情報を考慮すべきであることを当社が決定または承認することを意図したものではなく、またそのようなことを意図したものでもありません。
| Item 8.01 | Other Events. |
2024年1月8日、当社は "Atara Biotherapeutics to Present Recent Progress and Key Upcoming Milestones at the 42nd Annual J.P. Morgan Healthcare Conference "と題するプレスリリースを発表した。当社のプレスリリースのコピーは、本フォーム8-K最新報告書の別紙99.2として添付され、参照により本書に組み込まれる。
| Item 9.01 | Financial Statements and Exhibits. |
(d) Exhibits
| ExhibitNo. |
Description |
|
| 99.1 | 2024年1月8日付コーポレート・スライド・プレゼンテーション | |
| 99.2 | アタラ・バイオセラピューティクス社2024年1月8日付プレスリリース | |
| 104 | カバーページ インタラクティブデータファイル(inline xbrlドキュメントに埋め込まれています。) | |
SIGNATURES
1934年証券取引法の要件に従い、登録者は本報告書に正式に権限を付与された署名者により、登録者を代表して署名させた。
| ATARA BIOTHERAPEUTICS, INC. | ||||||
| Date: January 8, 2024 | By: | /s/ Eric Hyllengren |
||||
| エリック・ハイレングレン 最高財務責任者(正式な権限を与えられた役員および主席財務・会計責任者) | ||||||

Investor presentation 42nd Annual j.p. morgan healthcare conference monday, January 8, 2024 Nasdaq: ATRA Exhibit 99.1

Forward-Looking Statements This presentation and the accompanying oral presentation contain forward-looking statements made pursuant to the safe harbor provisions of the Private Securities Litigation Reform Act of 1995. All statements other than statements of historical facts contained in this presentation, including statements regarding our future results of operations and financial position, future transactions, business strategy, product, product candidates, correspondence and discussions with regulatory authorities, regulatory submissions, regulatory approvals, the initiation, timing, progress and results of preclinical studies and clinical trials and our research and development programs, the mechanistic link between EBV and multiple sclerosis and the ability of ATA188 to specifically target such link, ability to sell, manufacture or otherwise commercialize our product and product candidates, research and development costs, timing and likelihood of success, plans and objectives of management for future operations, any royalty payments, our ability to obtain and maintain intellectual property protection for our product and product candidates, and the sufficiency of Atara’s cash, cash equivalents, short-term investments to fund its planned operations are forward-looking statements of Atara Biotherapeutics, Inc. (“Atara” or the “Company”). These statements involve known and unknown risks, uncertainties and other important factors that may cause our actual results, performance or achievements to be materially different from any future results, performance or achievements expressed or implied by the forward-looking statements. In some cases you can identify these statements by forward-looking words such as “believe,” “may,” “will,” “estimate,” “continue,” “anticipate,” “intend,” “could,” “would,” “project,” “predict,” “plan,” “expect” or the negative or plural of these words or similar expressions. These forward-looking statements are subject to risks and uncertainties, including those discussed in Atara’s filings with the Securities and Exchange Commission (SEC), including in the “Risk Factors” and “Management’s Discussion and Analysis of Financial Condition and Results of Operations” sections of the Company’s most recently filed periodic reports on Form 10-K and Form 10-Q and subsequent filings and in the documents incorporated by reference therein. These risks and uncertainties include, without limitation, risks and uncertainties associated with the costly and time-consuming pharmaceutical product development process and the uncertainty of clinical success; the COVID-19 pandemic, and the wars in Ukraine and the Middle East, which may significantly impact (i) our business, research, clinical development plans and operations, including our operations in Southern California, Denver and at our clinical trial sites, as well as the business or operations of our third-party manufacturer, contract research organizations or other third parties with whom we conduct business, (ii) our ability to access capital, and (iii) the value of our common stock; the impact of future and pending legislation and regulations; the use of our information technology and communication systems and cybersecurity attacks; the sufficiency of our cash resources and need for additional capital, and other factors that may cause our or our industry's actual results, levels of activity, performance or achievements to be materially different from those anticipated by the forward-looking statements. Because forward-looking statements are inherently subject to risks and uncertainties, some of which cannot be predicted or quantified and some of which are beyond our control, you should not rely on these forward-looking statements as predictions of future events. The events and circumstances reflected in our forward-looking statements may not be achieved or occur and actual results could differ materially from those projected in the forward-looking statements. Except as required by applicable law, we do not plan to publicly update or revise any forward-looking statements contained herein, whether as a result of any new information, future events, changed circumstances or otherwise. Certain information contained in this presentation and statements made orally during this presentation relate to or are based on studies, publications, surveys and other data obtained from third-party sources and Atara's own internal estimates and research. While Atara believes these third-party studies, publications, surveys and other data to be reliable as of the date of this presentation, it has not independently verified, and makes no representation as to the adequacy, fairness, accuracy or completeness of, any information obtained from third-party sources. In addition, no independent source has evaluated the reasonableness or accuracy of Atara’s internal estimates or research and no reliance should be made on any information or statements made in this presentation relating to or based on such internal estimates and research. The content of this presentation is subject to copyright, which will be asserted by Atara and no part of this presentation may be reproduced, stored in a retrieval system, or transmitted in any form or by any means without prior permission in writing from Atara.

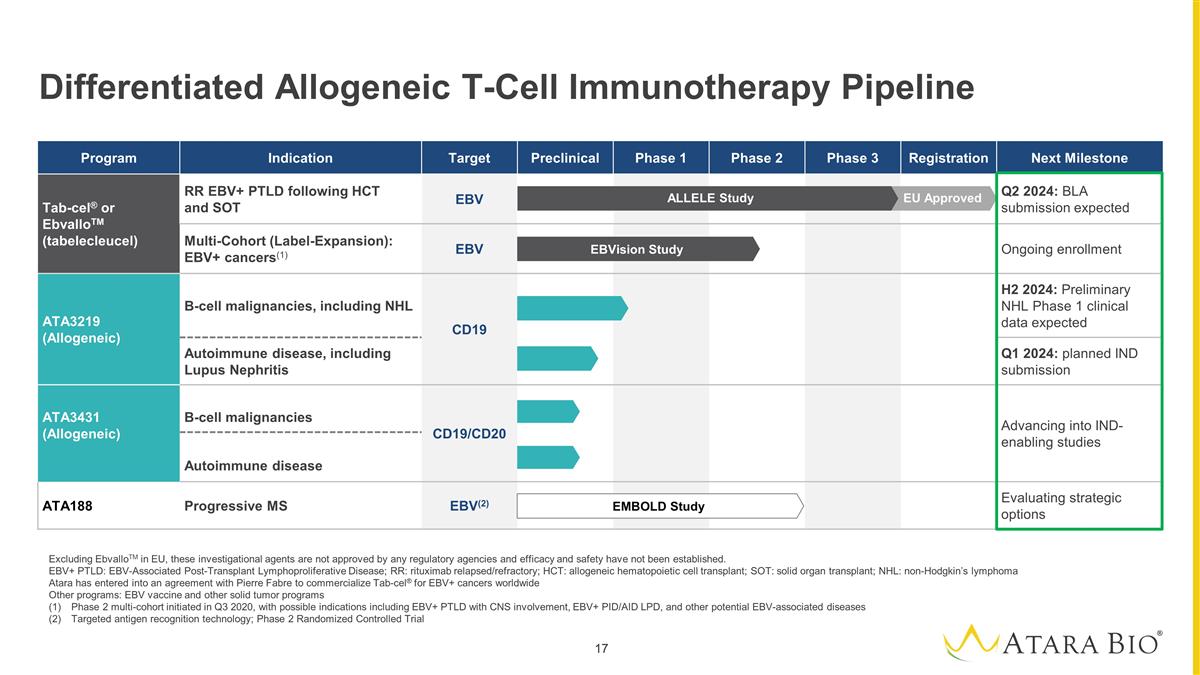
First Company to Obtain Regulatory Approval for an Allogeneic T-cell Immunotherapy EbvalloTM Approved by EMA in December 2022; BLA submission expected in Q2 2024 Expanded global tab-cel® partnership with Pierre Fabre closed in December 2023 Near-Term Milestones with ATA3219, Allogeneic CD19 CAR T Cell Incorporating Clinically-Validated Technologies Lupus nephritis IND filing anticipated Q1 2024 IND cleared in relapsed/refractory B-cell NHL with initial clinical data anticipated H2 2024 Focused Operational Activities and Associated Strategic Restructuring Extends Cash Runway into 2027 ATARA IS THE FIRST TO DELIVER ON THE TRANSFORMATIVE POTENTIAL OF ALLOGENEIC T-CELL THERAPY
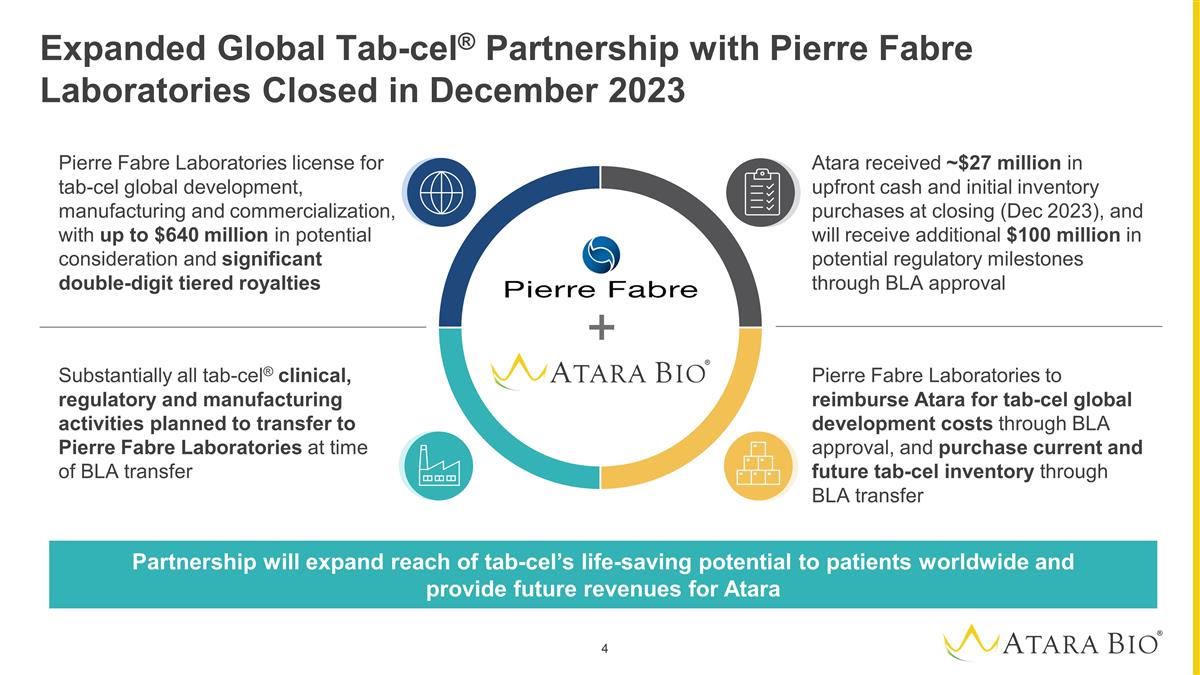
Expanded Global Tab-cel® Partnership with Pierre Fabre Laboratories Closed in December 2023 Pierre Fabre Laboratories license for tab-cel global development, manufacturing and commercialization, with up to $640 million in potential consideration and significant double-digit tiered royalties Pierre Fabre Laboratories to reimburse Atara for tab-cel global development costs through BLA approval, and purchase current and future tab-cel inventory through BLA transfer Substantially all tab-cel® clinical, regulatory and manufacturing activities planned to transfer to Pierre Fabre Laboratories at time of BLA transfer Atara received ~$27 million in upfront cash and initial inventory purchases at closing (Dec 2023), and will receive additional $100 million in potential regulatory milestones through BLA approval Partnership will expand reach of tab-cel’s life-saving potential to patients worldwide and provide future revenues for Atara

Tab-cel BLA Submission on Track for Q2 2024 Based on Strong Clinical File Latest Phase 3 ALLELE data cut analysis reinforces confidence in tab-cel BLA filing package 49% ORR (p<0.0001) in patient population aligned with intended U.S. label Favorable and consistent safety profile Other findings consistent with previous results, including DOR and estimated OS Separate pooled analysis including patients from ongoing tab-cel multicohort EBVision trial presented at ESMO-IO1 77.8% ORR in 18 EBV+ CNS PTLD patients, including first line PTLD setting Long-term survival, and favorable and consistent safety profile 1Annals of Oncology (2023) 20 (suppl_1): 100520-100520. 10.1016/iotech/iotech100520 ORR – Objective Response Rate; DOR – Durability of Response; OS – Overall Survival
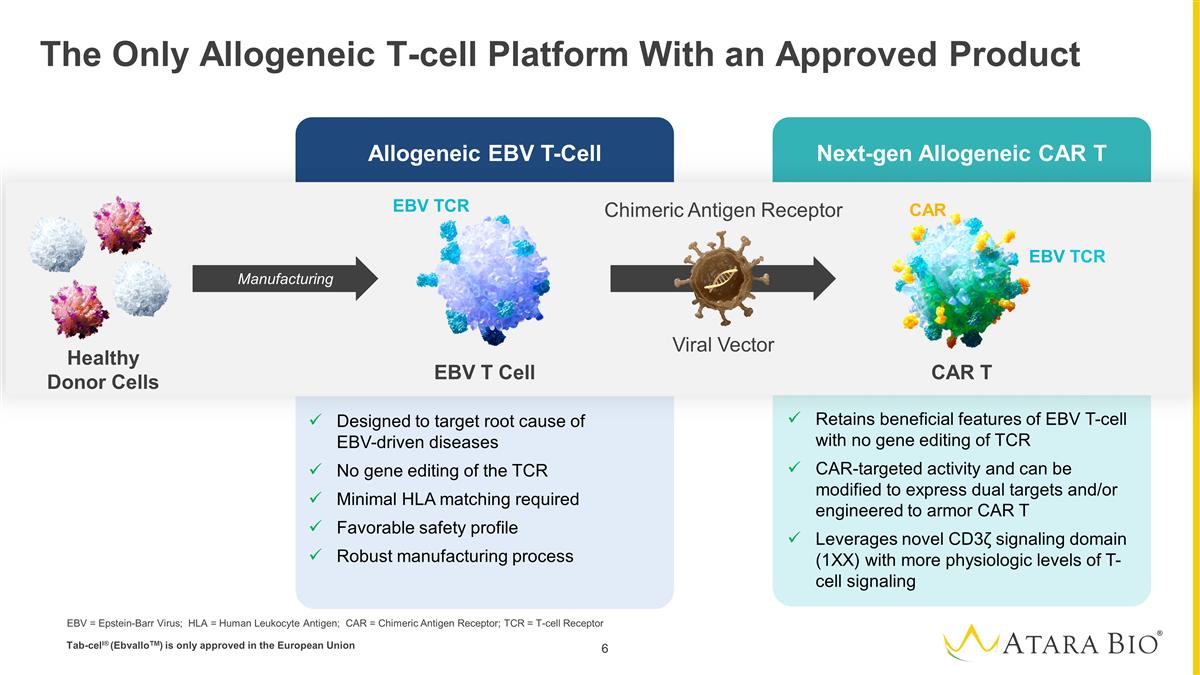
Allogeneic EBV T-Cell Next-gen Allogeneic CAR T The Only Allogeneic T-cell Platform With an Approved Product Designed to target root cause of EBV-driven diseases No gene editing of the TCR Minimal HLA matching required Favorable safety profile Robust manufacturing process Retains beneficial features of EBV T-cell with no gene editing of TCR CAR-targeted activity and can be modified to express dual targets and/or engineered to armor CAR T Leverages novel CD3ζ signaling domain (1XX) with more physiologic levels of T-cell signaling EBV T Cell CAR T Chimeric Antigen Receptor EBV TCR EBV TCR CAR Manufacturing Viral Vector Healthy Donor Cells EBV = Epstein-Barr Virus; HLA = Human Leukocyte Antigen; CAR = Chimeric Antigen Receptor; TCR = T-cell Receptor Tab-cell® (EbvalloTM) is only approved in the European Union
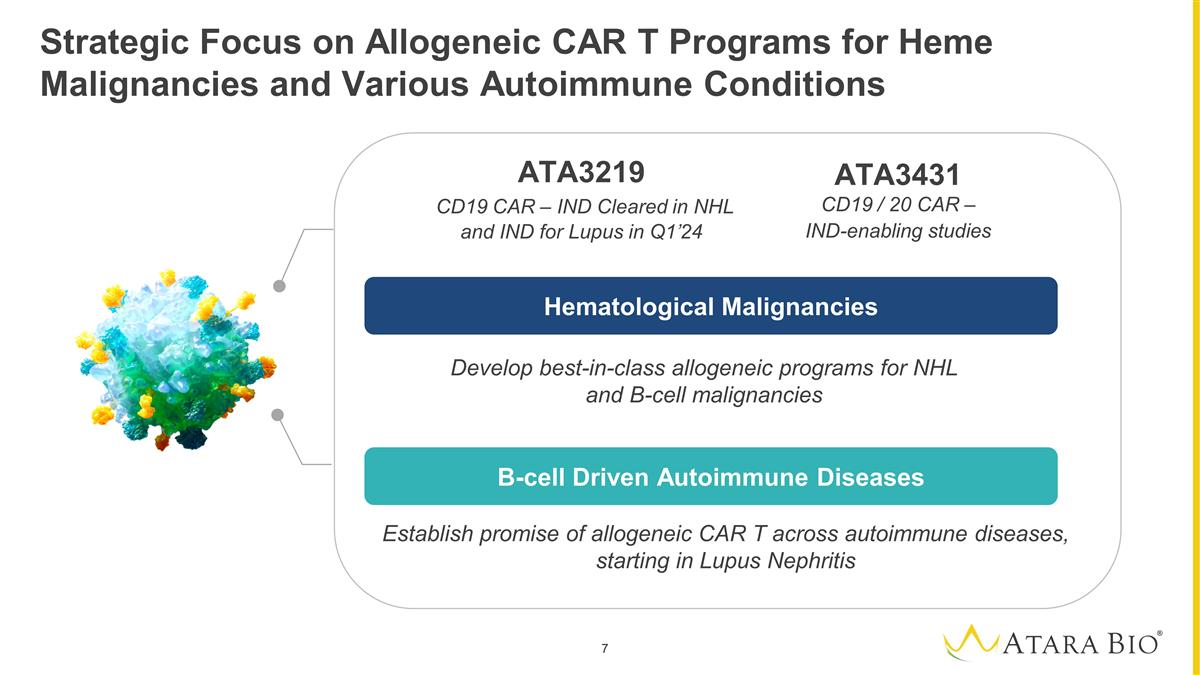
Strategic Focus on Allogeneic CAR T Programs for Heme Malignancies and Various Autoimmune Conditions Develop best-in-class allogeneic programs for NHL and B-cell malignancies Establish promise of allogeneic CAR T across autoimmune diseases, starting in Lupus Nephritis ` ` Hematological Malignancies B-cell Driven Autoimmune Disease Hematological Malignancies B-cell Driven Autoimmune Diseases ATA3219 CD19 CAR – IND Cleared in NHL and IND for Lupus in Q1’24 ATA3431 CD19 / 20 CAR – IND-enabling studies
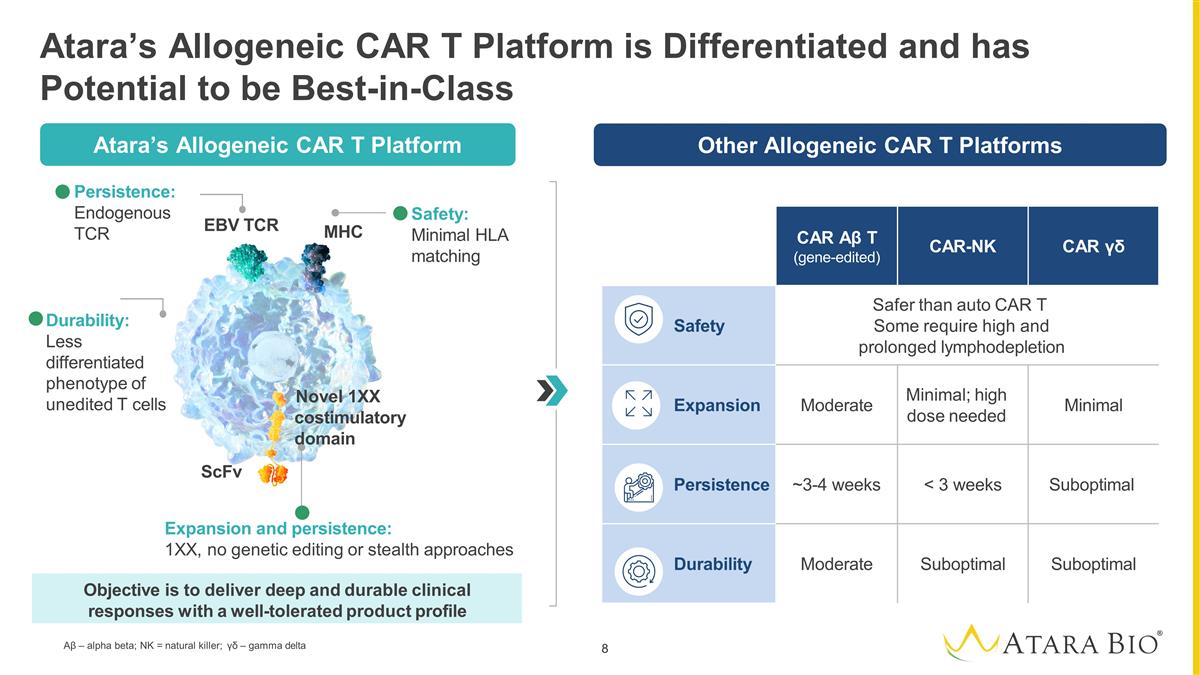
Other Allogeneic CAR Platforms Atara’s Allogeneic CAR T Platform is Differentiated and has Potential to be Best-in-Class CAR Αβ T (gene-edited) CAR-NK CAR γδ Safety Safer than auto CAR T Some require high and prolonged lymphodepletion Expansion Moderate Minimal; high dose needed Minimal Persistence ~3-4 weeks < 3 weeks Suboptimal Durability Moderate Suboptimal Suboptimal Other Allogeneic CAR T Platforms ScFv EBV TCR MHC Persistence: Endogenous TCR Expansion and persistence: 1XX, no genetic editing or stealth approaches Safety: Minimal HLA matching Objective is to deliver deep and durable clinical responses with a well-tolerated product profile Atara’s CAR Platform Durability: Less differentiated phenotype of unedited T cells Novel 1XX costimulatory domain Atara’s Allogeneic CAR T Platform Αβ – alpha beta; NK = natural killer; γδ – gamma delta

1. Park, JH et al. Poster 163A. ASH 2022. 2. Curran KJ, et al. ASH 2023. 3. Barba, P et al. Poster 439. ASH 2022. 9 Clinical Validation From Industry Leaders Substantiates Key Attributes of Our Allogeneic CAR T Platform TAK-940 CD19 auto CAR T with 1XX Dose level 1 (25M) resulted in ORR 89%, CR 78% (n=9)1 Memorial Sloan Kettering Allogeneic EBV CD19 CAR T Overall survival up to 3 years in post-transplant patients2 YTB323 Stem-enriched auto CD19 CAR T 69% durable CRs at 6 months (DL2 – 12.5M, n=30)3 1 2 3 Less differentiated T Cells Durability 1XX signaling domain Expansion and persistence Endogenous TCR & minimal HLA matching Persistence and safety
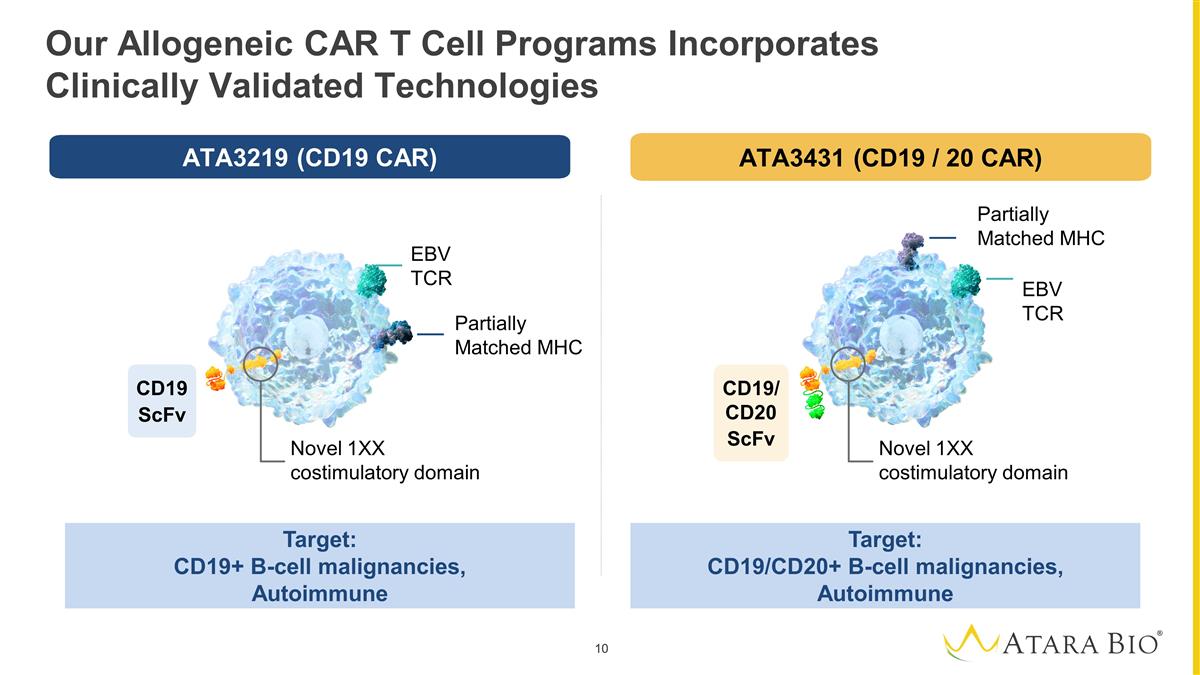
Our Allogeneic CAR T Cell Programs Incorporates Clinically Validated Technologies Target: CD19+ B-cell malignancies, Autoimmune Target: CD19/CD20+ B-cell malignancies, Autoimmune EBV TCR Partially Matched MHC Novel 1XX costimulatory domain Novel 1XX costimulatory domain Partially Matched MHC EBV TCR CD19 ScFv CD19/CD20 ScFv ATA3219 (CD19 CAR) ATA3431 (CD19 / 20 CAR)
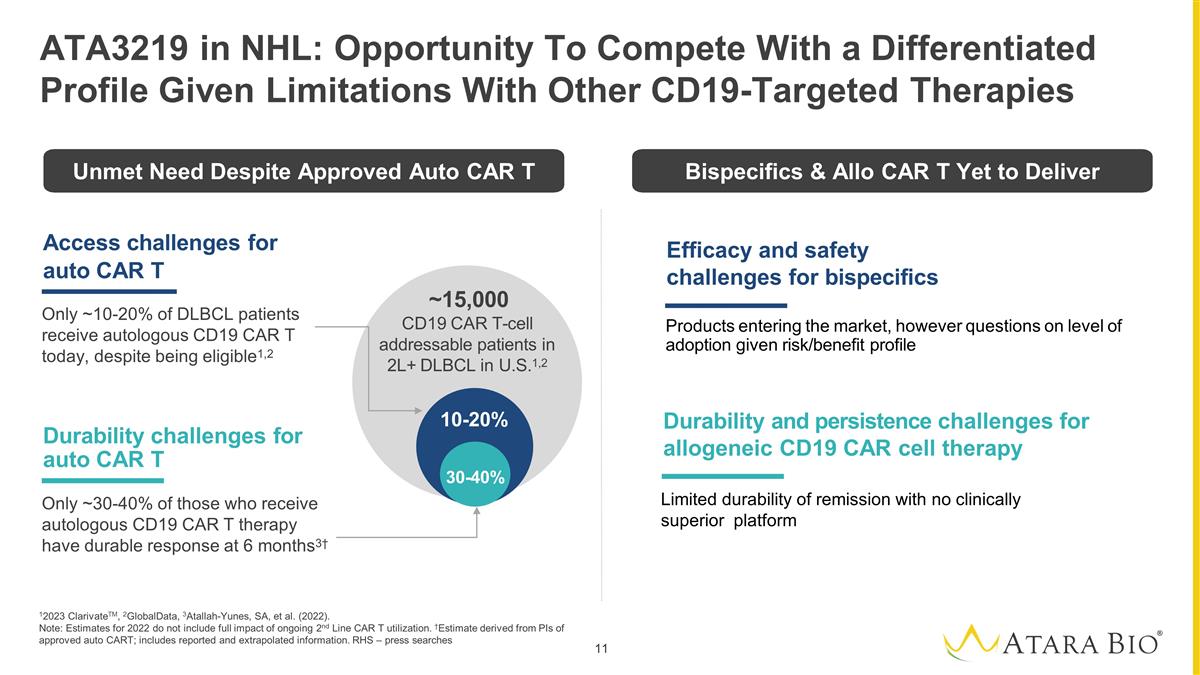
Access challenges for auto CAR T Only ~10-20% of DLBCL patients receive autologous CD19 CAR T today, despite being eligible1,2 Durability challenges for auto CAR T Only ~30-40% of those who receive autologous CD19 CAR T therapy have durable response at 6 months3† 10-20% 30-40% ~15,000 CD19 CAR T-cell addressable patients in 2L+ DLBCL in U.S.1,2 12023 ClarivateTM, 2GlobalData, 3Atallah-Yunes, SA, et al. (2022). Note: Estimates for 2022 do not include full impact of ongoing 2nd Line CAR T utilization. †Estimate derived from PIs of approved auto CART; includes reported and extrapolated information. RHS – press searches ATA3219 in NHL: Opportunity To Compete With a Differentiated Profile Given Limitations With Other CD19-Targeted Therapies Durability and persistence challenges for allogeneic CD19 CAR cell therapy Efficacy and safety challenges for bispecifics Products entering the market, however questions on level of adoption given risk/benefit profile Unmet Need Despite Approved Auto CAR T Bispecifics & Allo CAR T Yet to Deliver Limited durability of remission with no clinically superior platform

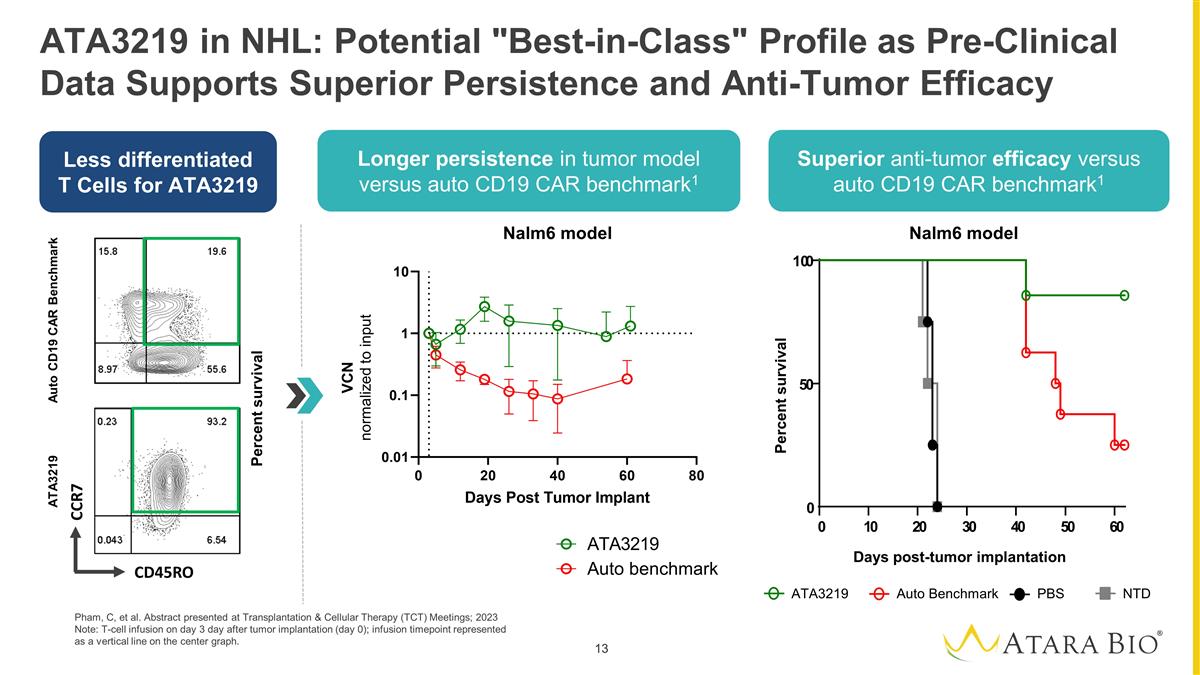
ATA3219 pre-clinical data demonstrated long-term in vivo expansion, polyfunctional phenotype, and efficient targeting of CD19 expressing tumor cells with low alloreactivity5 ATA3219 in NHL: IND Cleared and Phase 1 Study Commencing for Atara's First Allogeneic CAR T 1. Park, JH et al. Poster 163A. ASH 2022. 2. Stenger D, et al. Blood 2020. 3. Barba, P et al. Poster 439. ASH 2022. 4. Shahid, S et al. Poster presented at ASH; 2023. 5. Pham, C, et all. Abstract presented at Transplantation & Cellular Therapy (TCT) Meetings; 2023. Less differentiated T- cell phenotype clinically correlated to improved and durable clinical responses3 1XX signaling domain associated with favorable response rates, durability, and safety1 Retention of the well-defined, endogenous TCR, essential for the longevity of the response2 Proof-of-principle: An academic clinical study of an earlier-generation allogeneic CD19 targeted CAR EBV T-cell construct showed overall survival of up to three years in 12 patients with relapsed/refractory B-cell malignancies after hematopoietic cell transplant4 2 1 3 Novel 1XX costimulatory domain EBV TCR CD19 ScFv Partially Matched MHC 2 1 3 ATA3219: Next-generation off-the-shelf, allogeneic CD19-1XX CAR+ EBV T cell incorporates multiple clinically-validated technologies
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミア
会社

会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実
会社

会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になる
会社
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報を
会社
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報を
会社

Thank You Nasdaq: ATRA
会社開示情報をすべてご覧に
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧にな
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30
会社開示情報をすべてご覧になるには株探プレミアムの登録が必
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初め
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアム
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無
会社開示情報をすべてご覧になるには
会社
会社開示情報をすべてご覧になるには株探プレミアムの登録が
会社開示情報をす
会社開示情報をす
会社開示情報をすべてご覧に
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示
Next-Generation Allogeneic CAR-T Approach
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの
会社
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録
会社開示情報をすべてご覧になるには株探プレミアムの登録
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30日間の無料体験」実施中!会社開示
会社
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要
Alex Chapman
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「30
会社開示情報をすべてご覧になる
会社開示情報をすべてご覧になるには株探プレミ
会社開示情報をすべてご覧
会社開示情報をすべてご覧になるには株探プレミアムの登録が必要です。 初めての方には「3
会社開示情報をすべてご覧になる
会社開示情報をすべてご覧になるには株
# # #
 株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン
株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン