Document
Exhibit 99.1
リサータ・セラピューティクス社、2024年第2四半期決算報告および最新情報を発表
第2b相ASCEND試験のトップラインデータは2024年第4四半期に報告される予定である。
2026年初頭までの現在の事業と、データ収集までのすべての活発な研究に必要な資金を確保できる見込みである。
本日午後4時30分(米国東部時間)よりカンファレンスコールを開催予定
ニュージャージー州バスキングリッジ(2024年8月12日)-進行性固形がんおよびその他の重篤な疾患の治療のための革新的な治療法を開発する臨床段階の製薬企業であるリサータ・セラピューティクス社(Nasdaq: LSTA)(以下「リサータ社」または「当社」)は、事業の最新情報を提供し、2024年6月30日に終了した第2四半期の業績を報告しました。
「第2四半期は、当社の新規治験薬であるセルテペチドを中心に、進行中および計画中の複数の臨床試験を継続的に進め、リサータにとって力強い勢いを生み出しました。「第2b相試験であるASCEND試験のトップライン結果を含め、今後18ヶ月の間に複数の重要なデータが発表される予定であり、私たちは多くのことを楽しみにしています。これらの結果は、様々な規制当局との条件付き承認の検討や、転移性膵管腺癌(膵臓癌の中でも侵攻性が高く、致死的となることが多い)を対象とした最適化された第3相プログラムの設計を計画している当社にとって、変革の可能性を秘めています。2024年上半期に、セルテペタイドは骨肉腫において米国FDAの希少疾病用医薬品および希少小児疾患の指定を受け、欧州(EMA)では膵臓癌の小児集団におけるセルテペタイドの評価免除を受けた。これらの機関からの承認は、私たちの興奮とこの革新的な治療薬の幅広い治療可能性をさらに検証し、支持するものです。
私たちの継続的な慎重で戦略的な財務管理により、2026年初頭まで現在の事業運営に必要な資金を確保し、計画されたすべての臨床試験を完了させるために必要な資金を提供することができるという予測を再確認することができます。
Development Portfolio Highlights
他の抗癌剤と併用した固形癌治療薬としてのセルテペチド
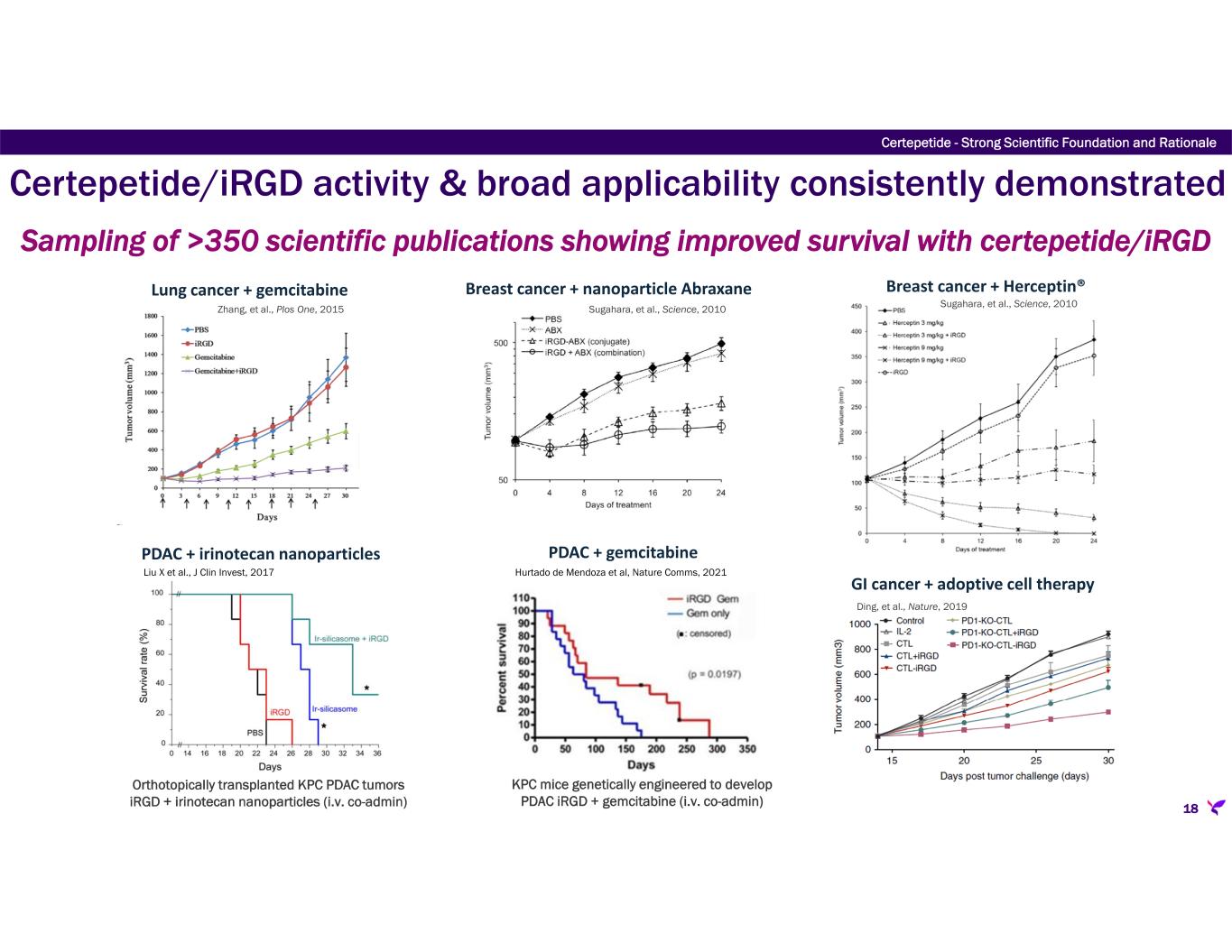
Certepetide(旧LSTA1)は、共投与または繋留された抗癌剤がより効果的に固形癌に浸透することを可能にする新規の取り込み経路を活性化するようにデザインされた治験薬である。Certepetideは腫瘍特異的にこの活性輸送系を作動させ、その結果、全身的に共投与された抗癌剤はより効率的に腫瘍に浸透し蓄積する。セルテペチドはまた、腫瘍微小環境を変化させ、免疫抑制性を低下させ、転移カスケードを阻害することも示されている。当社は、共同研究者とともに、免疫療法やRNAベースの治療薬を含む様々な既存および新規の抗癌剤の送達促進を実証する重要な非臨床データを蓄積してきた。現在までに、セルテペタイドは、膵臓癌に対する標準治療(SoC)化学療法の有効性を増強する能力を検証するためにデザインされた、完了済みおよび進行中の臨床試験において、良好な安全性、忍容性、臨床活性を実証しています。リサータ社は、様々な固形癌をより効果的に治療するための様々な治療法を可能にするセルテペチドの可能性を追求している。セルテペタイドは、膵臓癌のファスト・トラック指定(米国)および希少疾病用医薬品指定(米国および欧州)、神経膠腫(米国)および骨肉腫(米国)の希少疾病用医薬品指定を取得している。さらに、セルテペチドは骨肉腫(米国)で希少小児疾患指定を受けている。現在、セルテペタイドは、様々な固形がん種を対象に、様々な抗がん剤レジメンとの併用で、世界的に複数の第2a相および第2b相臨床試験が進行中または計画中である:
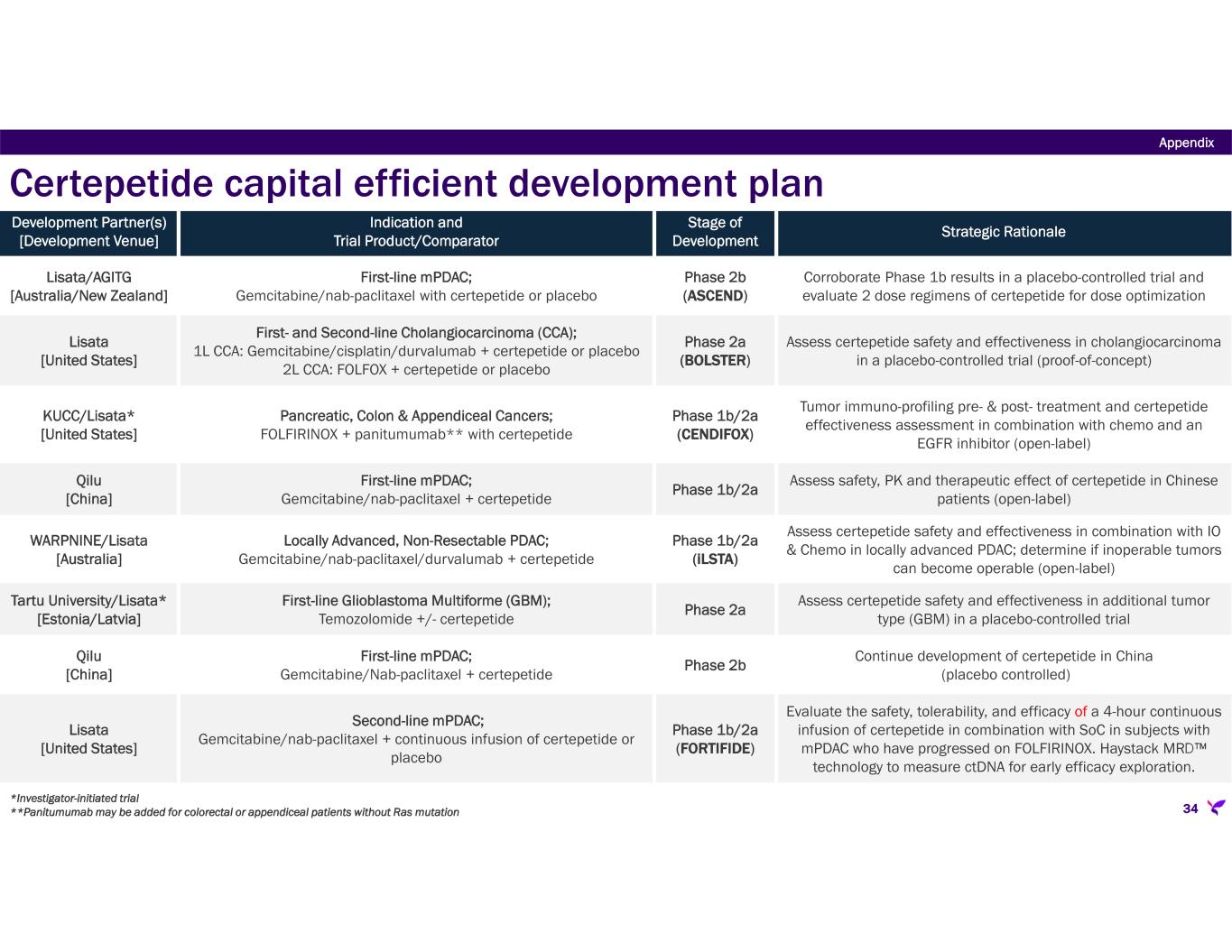
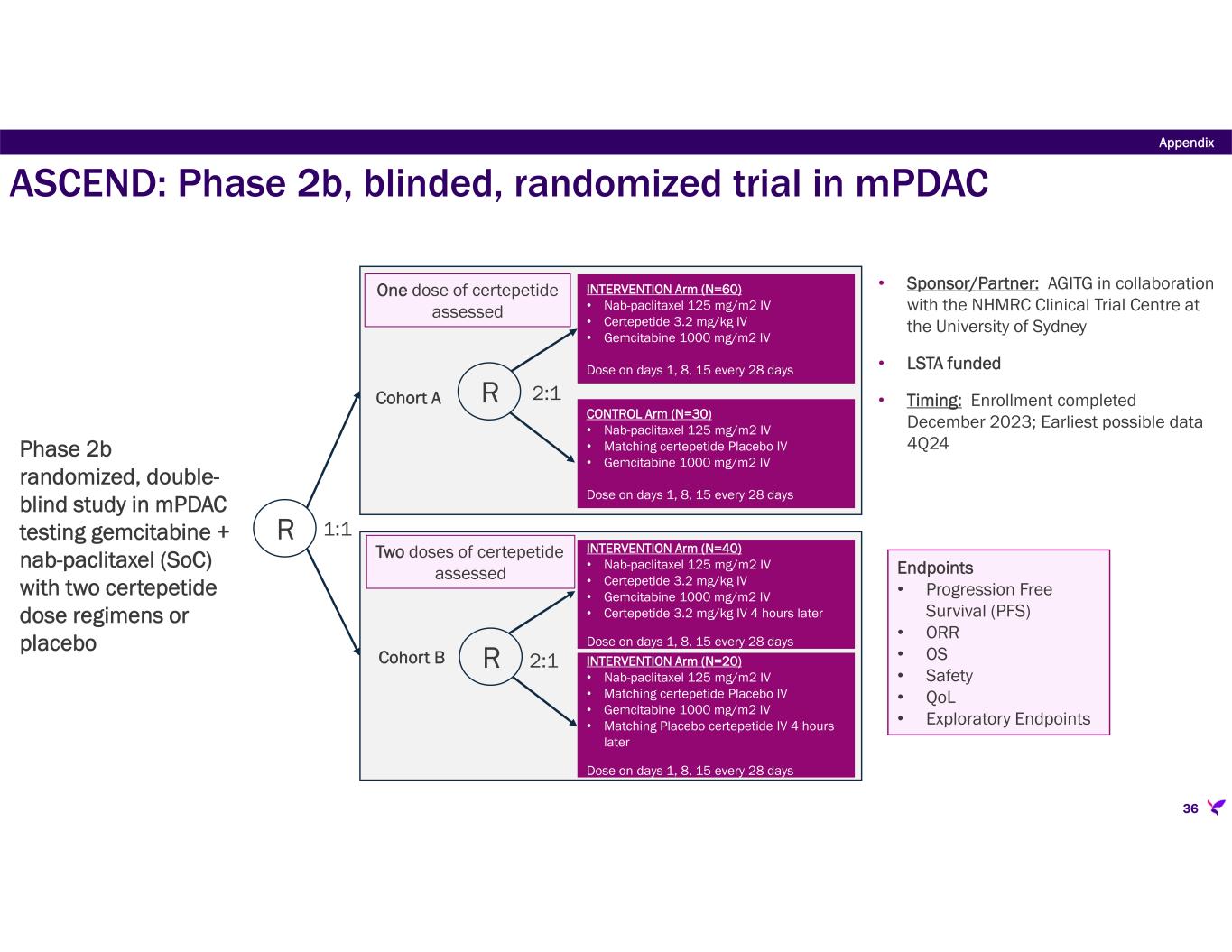
-ASCEND:転移性膵管腺癌(mPDAC)患者において、SoC化学療法(ゲムシタビン/ナブパクリタキセル)と併用したセルテペチドの2つの投与レジメンを評価する第2b相二重盲検無作為化プラセボ対照臨床試験。本試験のコホートAは、3.2mg/kgのセルテペチドをSoCと実質的に同時に単回投与し、コホートBはコホートAと同じであるが、1回目の投与の4時間後に2回目のセルテペチド3.2mg/kgを投与する。この試験は、シドニー大学と共同でAustralasian Gastro-Intestinal Trials Groupが中心となり、シドニー大学のNational Health and Medical Research Council Clinical Trial Centreを調整センターとして、オーストラリアとニュージーランドの25施設で実施されている。2023年に予定されていた独立データ安全性モニタリング委員会による無益性中間解析の結論は、無益性の条件は満たされておらず、試験は完了に進むべきであるというものであった。2023年第4四半期に臨床試験の登録が完了し、リサータ社では、コホートAに割り付けられた95人の患者からのトップラインデータが2024年第4四半期に報告され、158人の全患者の完全なデータセットが2025年半ばまでに入手可能になると見込んでいる。
-BOLSTER:米国におけるフェーズ2a二重盲検プラセボ対照多施設無作為化試験で、ファーストラインおよびセカンドラインの胆管がん(以下、CCA)を対象に、セルテペチドとSoCの併用療法を評価。当社は、CCAの一次治療における登録完了を計画より約半年前倒しで達成し、予想されるトップラインデータの読み出しを2025年半ばに前倒しした。この急速な登録率と、CCA一次治療後に進行した患者の治療成績を改善する差し迫った必要性に基づき、BOLSTER試験にはCCA二次治療の被験者を評価する第二コホートが追加されました。リサータ社は、2024年第4四半期までに最初の患者を登録する予定である。
-CENDIFOX:膵がん、結腸がん、虫垂がんを対象としたネオアジュバントFOLFIRINOX療法とセルテペチドの併用に関する米国での第1b/2a相非盲検試験。本試験は膵臓コホートの登録を完了し、2024年末までに残りの2つのコホートの登録を完了する予定。
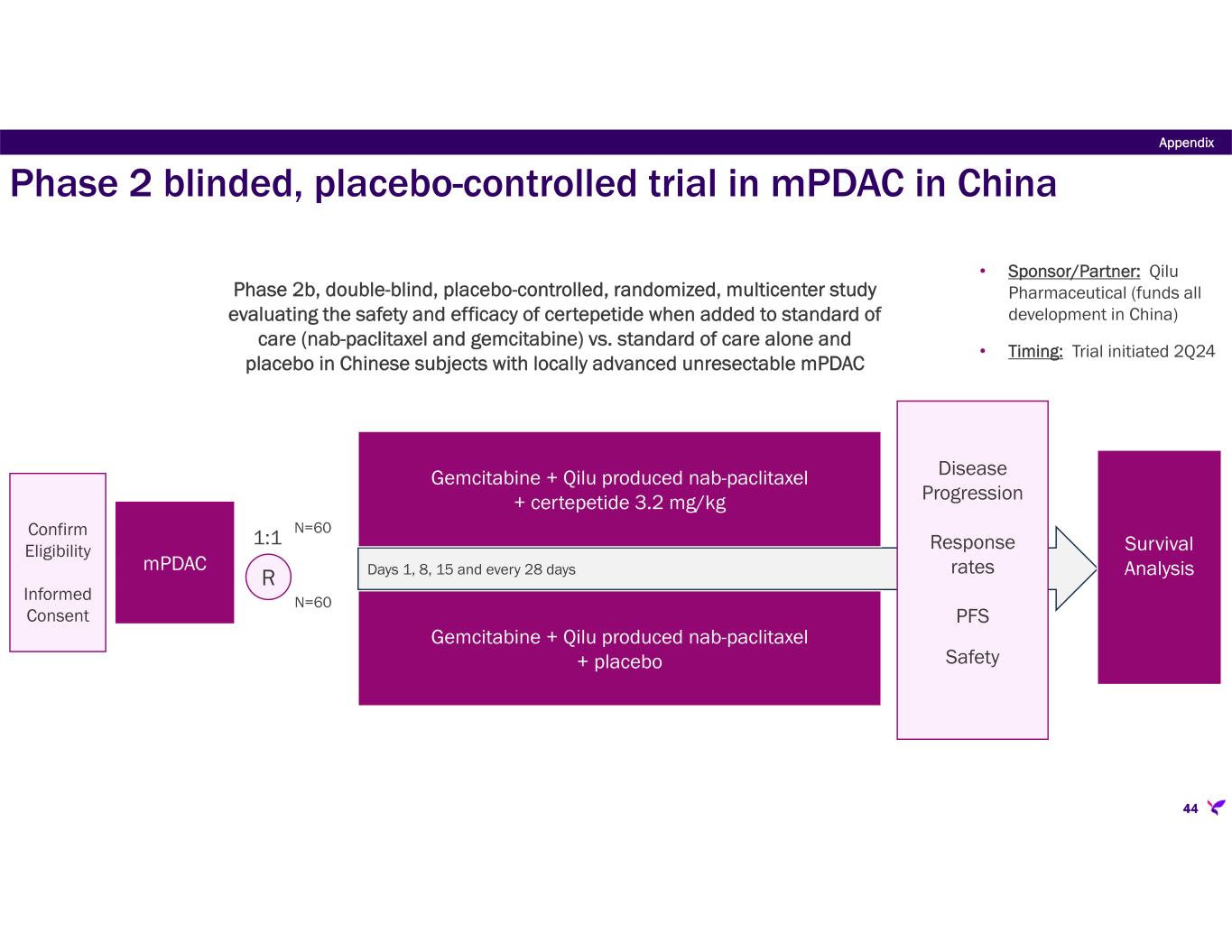
-大中華圏におけるセルテペチドのライセンシーである奇瑞医薬は、現在、mPDACの治療薬としてセルテペチドとゲムシタビンおよびナブパクリタキセルの併用療法を評価している。2023年のASCO年次総会において、Qilu Pharmaceuticalは、mPDAC患者を対象としてオーストラリアで実施されたセルテペタイドとゲムシタビンおよびナブパクリタキセルの併用療法の第1b/2a相試験から得られた既報の知見を裏付ける予備的データを共有する抄録を発表した。既報の通り、Qilu社はmPDAC患者を対象とした第2相プラセボ対照試験の治療を開始した。
-iLSTA:局所進行切除不能PDAC患者を対象に、チェックポイント阻害薬デュルバルマブとセルテペチドの併用療法とSoCゲムシタビンおよびナブパクリタキセル化学療法をSoC単独療法と比較評価するオーストラリアでの第1b/2a相無作為化単盲検安全性・薬力学的試験。登録完了は2024年後半を予定している。
-新たにGBMと診断された患者を対象に、セルテペチドとSoCテモゾロミドの併用療法とテモゾロミド単独療法を比較評価する、リサタ社出資の第2a相二重盲検プラセボ対照無作為化概念実証試験が、エストニアとラトビアの複数の施設で実施されており、セルテペチド治療群に有利な2:1の無作為割付で30人の患者登録を目標としている。
-FORTIFIDE:FOLFIRINOX療法で進行したmPDAC二次治療患者を対象に、SoCと併用したセルテペチドの4時間持続点滴の安全性、忍容性、有効性を評価する米国におけるフェーズ1b/2a、二重盲検、プラセボ対照、3群ランダム化試験。本試験の一環として、リサタ社は、セルテペチドの早期治療効果を分析するための探索的評価項目として、試験期間中、患者の複数のタイムポイントで循環腫瘍DNA濃度を測定するために、同社のMRD™技術を使用するHaystack Oncology社と契約しました。当社は、2025年前半までに本試験の最初の患者を登録する予定である。
2024年第2四半期財務ハイライト
2024年6月30日に終了した3ヶ月間の営業費用は550万ドルで、2023年6月30日に終了した3ヶ月間は690万ドルで、140万ドル(19.7%)減少した。
研究開発費は、2023年6月30日に終了した3カ月間の320万ドルに対し、2024年6月30日に終了した3カ月間は約260万ドルで、0.6百万ドル(17.7%)の減少となった。これは主に、前年度に登録が完了した第2b相ASCEND試験に関連する費用の減少、化学・製造・管理(CMC)関連費用の減少、株式費用の減少によるものですが、当年度のBOLSTER試験の登録活動に関連する費用の増加により一部相殺されました。
一般管理費は、2023年6月30日に終了した3ヶ月間が370万ドルであったのに対し、2024年6月30日に終了した3ヶ月間は約290万ドルであり、0.8百万ドル(21.3%)の減少となった。これは主に、2023年5月1日の最高事業責任者職の廃止に関連した前年度の一過性の退職金、持分費用の減少、および当年度の役員保険料の減少によるものである。
法人税等による利益は、2023年6月30日に終了した3ヵ月間が230万ドルであったのに対し、2024年6月30日に終了した3ヵ月間は0.0百万ドルであった。2023年4月、ニュージャージー州経済開発局の技術ビジネス税制優遇措置譲渡プログラムに従い、適格かつ承認された買い手に税制優遇措置を売却し、220万ドルの純収入を得た。
全体では、2024年6月30日に終了した3ヵ月間の純損失は500万ドルであった(2023年6月30日に終了した3ヵ月間は400万ドル)。
Balance Sheet Highlights
2024年6月30日現在、リサータは約3830万ドルの現金、現金同等物および有価証券を保有している。現在予想される資金需要に基づき、当社は、現在進行中および計画中のすべての臨床試験から予想されるデータのマイルストーンを包含し、2026年初頭まで現在提案されている事業を資金面で賄うことができると考えています。
Conference Call Information
リサータは、本日8月12日午後4時30分(米国東部時間)より、決算報告、事業報告、質疑応答のための電話会議を開催します。
参加を希望される方は、以下のリンクから電話会議に登録してください:登録はこちら登録された参加者には、電話会議の詳細とダイヤルインオプションが記載されたEメールが送信されます。カンファレンス・コールの遅延を避けるため、開始予定時刻の15分前にダイヤルすることをお勧めします。
電話会議のライブ・ウェブキャストは、リサタ・グループのウェブサイトの「投資家・ニュース」セクションからアクセスでき、電話会議終了の2時間後から12ヶ月間、再放送が可能です。
About Lisata Therapeutics
リサータ・セラピューティクス社は、進行性固形癌やその他の主要疾患の治療における革新的な治療法の発見、開発、商業化に取り組む臨床段階の製薬企業である。リサータの製品候補であるセルテペタイド(旧LSTA1)は、新規の取り込み経路を活性化するよう設計された治験薬であり、これにより共投与または繋留された抗癌剤が選択的に固形癌を標的とし、より効果的に浸透することを可能にする。リサータ社は、CendR Platform®技術に基づき、すでに注目すべき商業的および研究開発的パートナーシップを確立している。当社は、今後2年間で多くのマイルストーンを発表する予定であり、現在進行中および計画中の臨床試験から予想されるデータのマイルストーンを含め、2026年初頭までの事業運営に必要な資金を確保できると考えています。当社の詳細については、www.lisata.com。
Forward-Looking Statements
本コミュニケーションには、1995年米国私募証券訴訟改革法(Private Securities Litigation Reform Act of 1995)が提供するセーフハーバーの目的上、重大なリスクと不確実性を伴う「将来の見通しに関する記述」が含まれています。本コミュニケーションに含まれる当社の臨床開発プログラムに関する記述のうち、過去の事実に関する記述を除くすべての記述は、将来の見通しに関する記述です。さらに、本コミュニケーションで使用された場合、または使用された場合、リサータまたはその経営陣に関する「可能性がある」、「可能性がある」、「はずである」、「予想する」、「確信する」、「推定する」、「期待する」、「意図する」、「計画する」、「予測する」および類似の表現とその変形は、将来予想に関する記述を特定する可能性があります。将来予想に関する記述の例としては、転移性膵管腺癌およびその他の固形癌患者に対するセルテペチドの潜在的有効性、リサータのナスダック資本市場への上場継続に関する記述、リサータの資本、資源および所有構造に関する予想などがありますが、これらに限定されるものではありません;リサタ社が新規治療薬を発見・開発するために取っているアプローチ、リサタ社の将来の事業を支援するための資本の妥当性、臨床試験の開始と完了を成功させる能力、リサタ社の製品候補の開発期間とコストを予測することの難しさ。
実際の結果は、以下を含むがこれに限定されない様々な要因の結果、将来の見通しに関する記述に含まれるものとは大きく異なる可能性がある:単一の症例研究から観察された結果は、必ずしも最終的な結果を示すものではなく、より包括的なデータの検討後、また、より多くの患者データが入手可能になるにつれて、臨床結果の1つまたは複数が実質的に変化する可能性があります。これには、未確認の奏効が追跡評価後に最終的に治療に対する奏効が確認されないリスク、初期の研究および臨床試験で有望と思われた製品候補が、より大規模な臨床試験またはそれ以降の臨床試験で安全性および/または有効性が実証されないリスクなどが含まれます;リサタ社の製品候補の安全性と有効性、規制当局の決定とその時期、リサタ社の臨床プログラムにおける規制当局の遅延の期間と影響、リサタ社の事業資金調達能力、将来のマイルストーンとライセンス料の受領の可能性と時期、リサタ社の科学的研究の将来の成功、医薬品候補の開発と商業化を成功させるリサタ社の能力、臨床試験の開始と完了の時期、リサタ社の市場における急速な技術変化、リサタ社の知的財産権を保護する能力;および法律、規制、政治、経済の発展。実際の事象が予想と異なる可能性のある重要な要因に関する前述の検討は、網羅的なものとして解釈されるべきものではなく、2024年2月29日にSECに提出されたリサタの年次報告書(フォーム10-K)、およびリサタが証券取引委員会に提出したその他の文書に含まれるリスク要因を含め、本書およびその他の場所に記載されている記述と併せてお読みください。適用法で義務付けられている場合を除き、リサータは、新たな情報、将来の出来事、その他の結果にかかわらず、将来の見通しに関する記述を修正または更新する義務、またはその他の将来の見通しに関する記述を行う義務を負いません。
Contact:
Investors:
リサータ・セラピューティクス社
John Menditto
投資家対応・広報担当副社長 リサータ・セラピューティクス社財務データ(単位:千、1株当たりデータを除く)
Phone: 908-842-0084
Email: jmenditto@lisata.com
Media:
ICR Westwicke
Elizabeth Coleman
Senior Associate
Phone: 203-682-4783
Email: elizabeth.coleman@westwicke.com
- テーブル・トゥ・フォロー
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第1四半期(6月30日) 前半, |
|
6月30日までの6ヶ月間, |
|
|
2024 |
|
2023 |
|
2024 |
|
2023 |
|
|
(未監査) |
|
(未監査) |
|
(未監査) |
|
(未監査) |
|
| 損益計算書データ: |
|
|
|
|
|
|
|
|
| 研究開発費 |
$ |
2,601 |
|
|
$ |
3,162 |
|
|
$ |
5,842 |
|
|
$ |
6,341 |
|
|
| 一般管理費 |
2,922 |
|
|
3,713 |
|
|
6,282 |
|
|
7,378 |
|
|
| 営業費用合計 |
5,523 |
|
|
6,875 |
|
|
12,124 |
|
|
13,719 |
|
|
| Operating loss |
(5,523) |
|
|
(6,875) |
|
|
(12,124) |
|
|
(13,719) |
|
|
| Investment income, net |
493 |
|
|
668 |
|
|
1,082 |
|
|
1,338 |
|
|
| その他の費用(純額) |
(14) |
|
|
(150) |
|
|
(201) |
|
|
(163) |
|
|
| 法人税等及び非支配持分控除前当期純損失 |
(5,044) |
|
|
(6,357) |
|
|
(11,243) |
|
|
(12,544) |
|
|
| 法人税等のベネフィット |
— |
|
|
(2,330) |
|
|
(798) |
|
|
(2,330) |
|
|
| 純損失 |
(5,044) |
|
|
(4,027) |
|
|
(10,445) |
|
|
(10,214) |
|
|
| 控除:非支配持分に帰属する純利益 |
— |
|
|
— |
|
|
— |
|
|
— |
|
|
| lisata therapeutics, inc.の普通株主に帰属する当期純損失。 |
$ |
(5,044) |
|
|
$ |
(4,027) |
|
|
$ |
(10,445) |
|
|
$ |
(10,214) |
|
|
|
|
|
|
|
|
|
|
|
| 基本的および希薄化後1株当たり当社株主に帰属する損失額 |
$ |
(0.61) |
|
|
$ |
(0.50) |
|
|
$ |
(1.26) |
|
|
$ |
(1.28) |
|
|
| 加重平均発行済普通株式数 |
8,308 |
|
|
8,021 |
|
|
8,301 |
|
|
8,004 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
June 30, 2024 |
|
December 31, 2023 |
|
|
|
|
|
|
(未監査) |
|
|
|
| Balance Sheet Data: |
|
|
|
|
|
|
|
|
| 現金・現金同等物および市場性のある有価証券 |
|
|
|
$38,262 |
|
$50,535 |
|
| 資産合計 |
|
|
|
|
42,571 |
|
|
54,694 |
|
|
| 負債合計 |
|
|
|
|
4,576 |
|
|
6,800 |
|
|
| 資本合計 |
|
|
|
|
37,995 |
|
|
47,894 |
|
|
# # #










































 株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン
株探プレミアムに申し込む(初回無料体験付き)
プレミアム会員の方はこちらからログイン